
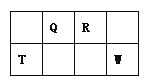
【题目】Q、R、T、W四种短周期元素在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为_______.
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(4)原子序数比R多1的元素的一种氢化物A能分解为其另一种氢化物B,写出A的电子式______.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H =________kJ/mol(注:题中所设单质均为最稳定单质)
【答案】(1)![]() (2) 弱于 (3) S + 2H2SO4(浓)
(2) 弱于 (3) S + 2H2SO4(浓)![]() 3SO2↑+ 2H2O
3SO2↑+ 2H2O
(4) ![]() (5)NaNO2(6)(3a – 4b)KJ/mol
(5)NaNO2(6)(3a – 4b)KJ/mol
【解析】
根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,则Q是C元素、R是N元素、W是S元素,再结合原子结构、元素周期律、物质的性质分析解答。
T所处的周期序数与主族序数相等,根据元素在周期表中的相对位置可知T是第三周期元素,则T是铝,所以Q是C,R是N,W是S。
(1)T是Al元素,其原子核外有3个电子层、最外层有3个电子,则其原子结构示意图为 ,因此,本题正确答案是:
,因此,本题正确答案是: ;
;
(2)同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以Q的非金属性弱于R,因此,本题正确答案是:弱于;
(3) W的单质与其最高价氧化物的水化物浓溶液即浓硫酸共热能发生反应,生成两种物质,其中一种是气体,由于浓硫酸具有强氧化性,因此该气体是SO2,则反应的化学方程式为S + 2H2SO4(浓)![]() 3SO2↑+ 2H2O。
3SO2↑+ 2H2O。
因此,本题正确答案是:S + 2H2SO4(浓)![]() 3SO2↑+ 2H2O;
3SO2↑+ 2H2O;
(4)原子序数比R多1的元素是O元素,O元素的一种氢化物能分解为它的另一种氢化物,则该氢化物为双氧水,则A为H2O2,其电子式为![]() ,
,
因此,本题正确答案是:![]() 。
。
(5)R有多种氧化物,其中甲的相对分子质量最小,则甲是NO。在一定条件下,2L的甲气体与0.5L的氧气相混合,二者的物质的量之比是4:1。若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则根据电子得失守恒可知氮元素的化合价升高到+3价,所以该含氧酸盐的化学式是NaNO2。
因此,本题正确答案是:NaNO2;
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ,则反应的热化学方程式分别是①C(s)+O2(g)=CO2(g) △H=—akJ/mol,②Al(s)+3/4O2(g)=1/2Al2O3(s) △H=—bkJ/mol。则根据盖斯定律可知②×4—①×3即可得到4Al(s)+3CO2(g)=2Al2O3(s)+3C(s) △H=(3a–4b)kJ/mol。
因此,本题正确答案是:(3a–4b)。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
C.水解反应NH4++H2O![]() NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
D.盐类水解反应的逆反应是中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙述中,正确的是( )

A. 通常情况下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的电负性比X的的电负性大
D. 第一电离能:R>W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如下图所示。
![]()
下列说法不正确的是
A.NO属于共价化合物
B.O2含有非极性共价键
C.过程②吸收能量,过程③释放能量
D.标准状况下,NO分解生成11.2LN2转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A(g)+B(g)![]() 2C(g),图中的曲线是该反应在不同温度下的平衡曲线,则下列描述不正确的是( )
2C(g),图中的曲线是该反应在不同温度下的平衡曲线,则下列描述不正确的是( )

A.该反应是吸热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1时若由a点达到平衡,可以采取增大压强的方法
D.c点v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示几种无机物之间的转化关系,其中A、B均为黑色粉末,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色。

请回答下列问题:
(1)A的化学式是___,C的电子式是 __________ ,Y的名称是_____。
(2)反应①的化学方程式为 __________________________。
(3)实验室测定气体E的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示) _________________。
(4)19.2g的D与足量的一定浓度X的溶液反应,将所得的气体与_______L O2(标准状况下)混合,恰好能被水完全吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,各物质浓度随时间变化的关系如图所示:

计算该反应的平衡常数K=________。反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol·L-1。第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1________w2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )

①X、Y的最高价氧化物的水化物酸性为Y<X;②Y、Z的气态氢化物的稳定性Y<Z;③W的单质常温下呈液态,一定条件下可与铁粉反应;④W的原子序数比Z大9。
A. 只有③ B. ①② C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某溶液中只有Na+、CH3COO、H+、OH四种离子。某同学推测该溶液中离子浓度可能有如下四种关系:
A.c(Na+)>c(CH3COO)>c(OH)>c(H+) B.c(Na+)>c(CH3COO)>c(H+)>c(OH)
C.c(Na+)>c(OH)>c(CH3COO)>c(H+) D.c(CH3COO)>c(Na+)>c(H+)>c(OH)
①若溶液中只溶解了一种溶质,该溶质的名称是_________,上述离子浓度大小关系中正确的是(填序号)_____。
②若上述关系中D是正确的,则溶液中溶质的化学式是________。
③若该溶液由体积相等的醋酸与NaOH溶液混合而成,且溶液恰好呈中性,则混合前c(CH3COOH)(填“>”“<”“=”,下同)___________c(NaOH),混合后c(CH3COO)与c(Na+)的关系是c(CH3COO)__________c(Na+)。
(2)Na2S可用于制造硫化染料、沉淀水体中的重金属等。
①Na2S溶液中S2水解的离子方程式为____________________________________。
金属硫化物 | FeS | PbS | CuS | HgS |
Ksp | 6.3×1018 | 1.0×1028 | 6.3×1036 | 1.6×1052 |
②室温时,几种重金属离子的硫化物的溶度积常数如下表:
则:向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是____;用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×106mol/L],则应满足溶液中c(S2)≥_____mol/L;反应Cu2+(aq)+FeS(s) ![]() Fe2+(aq)+CuS(s)的平衡常数K=_______。
Fe2+(aq)+CuS(s)的平衡常数K=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com