
【题目】下列说法不正确的是( )
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
C.水解反应NH4++H2O![]() NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
D.盐类水解反应的逆反应是中和反应
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是
A.2H2O2 ![]() 2H2O + O2↑B.NH4Cl
2H2O + O2↑B.NH4Cl![]() NH3↑ + HCl↑
NH3↑ + HCl↑
C.2Al + Fe2O3![]() 2Fe + Al2O3D.Cu + 2H2SO4(浓)
2Fe + Al2O3D.Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下、1L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示,下列有关说法正确的是
x | y | w | |
n(起始)/mol | 2 | l | 0 |
n(平衡)/mol | l | 0.5 | 1.5 |
A. 该温度下,此反应的平衡常数表达式是![]()
B. 升高温度,若w的体积分数减小,则此反应ΔH>0
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向容器中通入3molw,达到平衡时,n(x)=2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905 kJ·mol-1
2H2(g)十O2(g)=2HO(g):△H=--483.6 kJ·mol-1
则N2(g)+3H2(g)![]() 2NH3(g)的△H=___________。
2NH3(g)的△H=___________。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3)______________;
②达到平衡时NH3的体积分数为______________________。
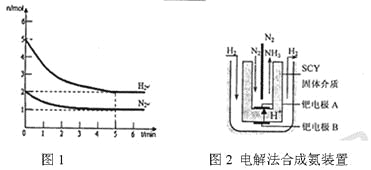
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界铅生产和铅消费的最大国,而铅的冶炼方法具有成本高、污染严重等缺点。化学沉淀法是除去酸性废水中Pb2+的主要方法,根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法、磷酸盐沉淀法、铁氧体沉淀法等。水溶液中各形态铅的百分含量x与溶液pH变化的关系如图所示。向含Pb2+的溶液中逐滴滴加NaOH溶液,溶液变浑浊,继续滴加NaOH溶液又变澄清。
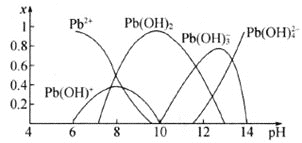
(1)若采用氢氧化物沉淀法除去溶液中的Pb2+,应将溶液的pH调至约为___。pH≥13时,溶液中发生的主要反应的离子方程式为___。
(2)向酸性含铅废水中加Na2S可将Pb2+转化为PbS除去,使用该方法通常先将溶液pH调至6左右,若溶液pH过低会导致___。已知Kap(PbS)=8.0×10-28,国家规定的废水排放标准中铅含量不高于0.5 mgL-1,若某工厂处理过的废水中S2-浓度为2.0×10-20molL-1,该废水中铅含量___(填“已经”或“尚未”)达到国家规定的排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)HClO的电离方程式为__________________________。
(2)用离子方程式解释铁盐可用于净水的原理__________________________。
(3)在NaOH 溶液中逐渐加入稀醋酸至溶液呈中性,则所得溶液中c(Na+)_______c(CH3COO-)(填“>”“<”或“=”下同)。
(4)相同pH的NH4Cl溶液与NH4HSO4溶液中NH4+浓度的大小关系:前者_______后者。
(5)用惰性电极电解500mL某浓度的CuSO4溶液一段时间后,CuSO4刚好反应完,需要加入16gCuO才能复原,则原CuSO4溶液的物质量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、T、W四种短周期元素在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
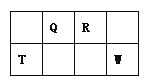
(1)T的原子结构示意图为_______.
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(4)原子序数比R多1的元素的一种氢化物A能分解为其另一种氢化物B,写出A的电子式______.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H =________kJ/mol(注:题中所设单质均为最稳定单质)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com