
【题目】(1)已知某溶液中只有Na+、CH3COO、H+、OH四种离子。某同学推测该溶液中离子浓度可能有如下四种关系:
A.c(Na+)>c(CH3COO)>c(OH)>c(H+) B.c(Na+)>c(CH3COO)>c(H+)>c(OH)
C.c(Na+)>c(OH)>c(CH3COO)>c(H+) D.c(CH3COO)>c(Na+)>c(H+)>c(OH)
①若溶液中只溶解了一种溶质,该溶质的名称是_________,上述离子浓度大小关系中正确的是(填序号)_____。
②若上述关系中D是正确的,则溶液中溶质的化学式是________。
③若该溶液由体积相等的醋酸与NaOH溶液混合而成,且溶液恰好呈中性,则混合前c(CH3COOH)(填“>”“<”“=”,下同)___________c(NaOH),混合后c(CH3COO)与c(Na+)的关系是c(CH3COO)__________c(Na+)。
(2)Na2S可用于制造硫化染料、沉淀水体中的重金属等。
①Na2S溶液中S2水解的离子方程式为____________________________________。
金属硫化物 | FeS | PbS | CuS | HgS |
Ksp | 6.3×1018 | 1.0×1028 | 6.3×1036 | 1.6×1052 |
②室温时,几种重金属离子的硫化物的溶度积常数如下表:
则:向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是____;用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×106mol/L],则应满足溶液中c(S2)≥_____mol/L;反应Cu2+(aq)+FeS(s) ![]() Fe2+(aq)+CuS(s)的平衡常数K=_______。
Fe2+(aq)+CuS(s)的平衡常数K=_______。
【答案】醋酸钠 A CH3COOH; CH3COONa > = S2-+H2O![]() HS-+OH- Hg2+ 1.0
HS-+OH- Hg2+ 1.0![]() 10-22 1018
10-22 1018
【解析】
根据溶液中离子浓度的大小判断溶液中存在的物质,根据电荷守恒判断溶液中离子浓度的大小;根据盐类水解规律书写水解反应方程式;根据沉淀溶解平衡常数判断离子沉淀的先后。
(1)①因为溶液中只存在一种溶质,且水电离产生氢离子和氢氧根,所以溶质为醋酸钠;醋酸根在溶液中存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,消耗了醋酸根,所以醋酸根浓度小于钠离子浓度,且反应生成了氢氧根,则氢氧根浓度大于氢离子浓度,溶液中离子大小的关系为:c(Na+)>c(CH3COO)>c(OH)>c(H+),故A正确。答案为:醋酸钠;A;
CH3COOH+OH-,消耗了醋酸根,所以醋酸根浓度小于钠离子浓度,且反应生成了氢氧根,则氢氧根浓度大于氢离子浓度,溶液中离子大小的关系为:c(Na+)>c(CH3COO)>c(OH)>c(H+),故A正确。答案为:醋酸钠;A;
②由D中离子大小的关系为:c(CH3COO)>c(Na+)>c(H+)>c(OH)可知溶液呈酸性,且醋酸根离子浓度大于钠离子浓度,则电离平衡进行的程度大于水解平衡进行的程度,所以溶液中存在醋酸和醋酸钠,其化学式为:CH3COOH和CH3COONa;答案:CH3COOH和CH3COONa;
③若醋酸恰好完全与氢氧化钠反应生成醋酸钠,溶液呈碱性,现溶液呈中性,所以醋酸的浓度应大于氢氧化钠的浓度,因此c(CH3COOH)>c(NaOH),又因为溶液中只存在Na+、CH3COO-、H+、OH,根据电荷守恒:c(Na+)+ c(H+)=c(CH3COO-)+c(OH),溶液呈电中性c(H+)= c(OH),所以c(CH3COO)=c(Na+);答案:>,=;
(2)①Na2S为强碱弱酸盐,水解呈碱性,水解的离子方程式为S2- + H2O![]() HS-+OH -,故答案为: S2- + H2O
HS-+OH -,故答案为: S2- + H2O![]() HS-+OH -;
HS-+OH -;
②①溶度积越小,越易生成沉淀,由表中数据可知HgS的Ksp最小,所以最先生成沉淀的离子是Hg2+;由Ksp(PbS) = c(Pb+) (S2- )= 1.0×1028可知,要使Pb2+沉淀完全c(Pb2+)≤1![]() 10-6mol·L-1,则应满足溶液中c(S2- )≥
10-6mol·L-1,则应满足溶液中c(S2- )≥![]() =1.0
=1.0![]() 10-22;反应
10-22;反应 ![]() (aq)+FeS(s)
(aq)+FeS(s) ![]() Fe2+(aq)+CuS(s)的平衡常数K=
Fe2+(aq)+CuS(s)的平衡常数K= =
=![]() =
=![]() =1018,故答案为:Hg2+ ,1.0
=1018,故答案为:Hg2+ ,1.0![]() 10-22,1018。
10-22,1018。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】Q、R、T、W四种短周期元素在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
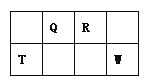
(1)T的原子结构示意图为_______.
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(4)原子序数比R多1的元素的一种氢化物A能分解为其另一种氢化物B,写出A的电子式______.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H =________kJ/mol(注:题中所设单质均为最稳定单质)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2 L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B、C物质的量变化如下图(Ⅰ)所示。若保持其它条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列叙述正确的是
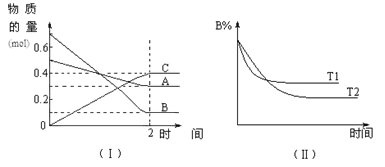
A.2 min内A的化学反应速率为0.1 mol/(L·min)
B.在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C.在反应达平衡时,其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D.在T℃时,若A的浓度减少了1 mol/L,则B的浓度会减少3 mol/L,C的浓度会增加2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定溶液中一定能大量共存的离子组是
A.pH=1的无色溶液中:NH![]() 、Na+、Fe3+、
、Na+、Fe3+、![]()
B.含有大量Ba2+的溶液中:Na+、K+、HCO![]() 、NO
、NO![]()
C.中性溶液中:K+、Fe3+、Cl-、![]()
D.Na2S溶液中:![]() 、K+、Fe3+、Cl-
、K+、Fe3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 | 先出现白色沉淀后又生成红褐色沉淀 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
C | 在滴有酚酞的Na2CO3溶液中, 加入BaC12 | 溶液红色褪去 | CO32-在溶液中存在水解平衡 |
D | 常温下,测定盐酸和醋酸溶液的pH | 盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:101 kPa时,1molH2完全燃烧生成液态水,放出285.8 kJ的热量;1molCH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列能表示燃烧热的热化学方程式是
A.CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=890.3 kJ
CO2(g)+2H2O(l) ΔH=890.3 kJ
B.CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol1
CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol1
C.CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=890.3 kJ·mol1
CO2(g)+2H2O(g) ΔH=890.3 kJ·mol1
D.H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=285.8 kJ·mol1
H2O(l) ΔH=285.8 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标况下672mL气体。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2恰好使气体完全溶于水中,则通入的O2的体积是( )
A.336mLB.168mLC.224mLD.112mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到实验目的的是
选项 | 实验目的 | 操作 |
A | 取20.00 mL盐酸 | 在25 mL酸式滴定管中装入盐酸。调整初始读数为5.00 mL后,将剩余盐酸全部放入锥形瓶中 |
B | 测量饱和Na2CO3溶液的pH值 | 用蒸馏水湿润pH试纸,放入Na2CO3溶液中,观察pH试纸颜色,并与比色卡对比,读出pH值 |
C | 制取纯净的FeCl 3固体 | 加热蒸干FeCl3溶液 |
D | 验证Ksp[Cu(OH)2]< Ksp[Mg(OH)2] | 将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol/L CuSO4溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com