
����Ŀ��T��ʱ����2 L���ܱ������У�A������B���巢�����淴Ӧ����C���壬��Ӧ������A��B��C���ʵ����仯����ͼ��������ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��B�����ʵ���������ʱ���ϵ����ͼ��������ʾ������������ȷ����
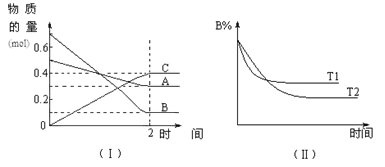
A.2 min��A�Ļ�ѧ��Ӧ����Ϊ0.1 mol/(L��min)
B.�ڷ�Ӧ��ƽ��ʱ�����������������䣬����ѹǿ�����淴Ӧ���ʶ�������ƽ�����淴Ӧ�����ƶ�
C.�ڷ�Ӧ��ƽ��ʱ�������������䣬�����¶ȣ����淴Ӧ���ʶ�������A��ת��������
D.��T��ʱ����A��Ũ�ȼ�����1 mol/L����B��Ũ�Ȼ����3 mol/L��C��Ũ�Ȼ�����2 mol/L
���𰸡�D
��������
A.2 min��A�Ļ�ѧ��Ӧ����Ϊv(A)=(0.5mol-0.3mol)��2L��2min=0.05mol/(L��min)��A����
B.���ڸ÷�Ӧ�ǿ��淴Ӧ�����ݷ�Ӧ�����ʵ����仯��ϵ����֪�÷�Ӧ�ķ���ʽ��A+3B![]() 2C, �÷�Ӧ������Ӧ�����������С�ķ�Ӧ���ڷ�Ӧ��ƽ��ʱ�����������������䣬����ѹǿ�������淴Ӧ���ʶ�������ƽ�������������С������Ӧ�����ƶ���B����
2C, �÷�Ӧ������Ӧ�����������С�ķ�Ӧ���ڷ�Ӧ��ƽ��ʱ�����������������䣬����ѹǿ�������淴Ӧ���ʶ�������ƽ�������������С������Ӧ�����ƶ���B����
C.��ͼ��֪T1>T2�������¶ȣ�B�ĺ�������˵�������¶Ȼ�ѧƽ�����淴Ӧ�����ƶ�������A��ת���ʽ��ͣ�C����
D.�÷�Ӧ�ķ���ʽ�ǣ�A+3B![]() 2C�����ʷ�Ӧʱ�����ʵ���Ũ�ȹ�ϵ�ǣ�c(A):c(B):c(C)=1:3:2��������T��ʱ����A��Ũ�ȼ�����1 mol/L����B��Ũ�Ȼ����3 mol/L��C��Ũ�Ȼ�����2 mol/L��D��ȷ��
2C�����ʷ�Ӧʱ�����ʵ���Ũ�ȹ�ϵ�ǣ�c(A):c(B):c(C)=1:3:2��������T��ʱ����A��Ũ�ȼ�����1 mol/L����B��Ũ�Ȼ����3 mol/L��C��Ũ�Ȼ�����2 mol/L��D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ�ǰ�����ڵ�һ���֣������й�R��W��X�� Y��Z����Ԫ�ص������У���ȷ���ǣ� ��

A. ͨ�����������Ԫ�صĵ����У�Z���ʵķе����
B. Y��Z�������ӵ��Ӳ�ṹ����Rԭ�ӵ���ͬ
C. W�ĵ縺�Ա�X�ĵĵ縺�Դ�
D. ��һ�����ܣ�R��W��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����NO2��N2O4�Ļ������ͨ�����Ϊ1 L�ĺ����ܱ������У�������Ũ����ʱ��仯�Ĺ�ϵ��ͼ��ʾ��

����÷�Ӧ��ƽ�ⳣ��K��________����Ӧ���е�20 minʱ�����������ڳ���һ����NO2,10 min��ﵽ�µ�ƽ�⣬��ʱ���c(NO2)��0.9 mol��L��1����һ��ƽ��ʱ���������NO2���������Ϊw1���ﵽ��ƽ�����������NO2���������Ϊw2����w1________w2(�����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾԪ�����ڱ�ǰ�����ڵ�һ���֣�����Ԫ��X��Y��Z��W��������ȷ���ǣ� ��

��X��Y������������ˮ��������ΪY��X����Y��Z����̬�⻯����ȶ���Y��Z����W�ĵ��ʳ����³�Һ̬��һ�������¿������۷�Ӧ����W��ԭ��������Z��9��
A. ֻ�Т� B. �٢� C. �٢ڢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij���ݻ�Ϊ2 L���ܱ������ڣ���T��ʱ����ͼ1��ʾ������Ӧ��

mA(g)+nB(g)![]() pD(g)+qE(s) H<0��m��n��p��q����������������
pD(g)+qE(s) H<0��m��n��p��q����������������
��1������ͼ1��ʾ����Ӧ��ʼ���ﵽƽ��ʱ����D��ʾ�÷�Ӧ����Ϊ____________ mol/��L��min��������ʽ��m:n:p:q =________________
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ��KΪ_________________(������һλС��)��
��3�����д�ʩ������B��ת���ʵ��� �� ��
A�������¶� B�������������ͨ��1molB
C��������������Ƴ���������D(g) D�����������ݻ�����Ϊԭ����2��
E. �����������ͨ��1mol A
��4�����жϸ÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬���ǣ� ��
A�����ݺ���ʱ����������ѹǿ���ֲ���
B�����������DŨ�Ȳ���
C��v(A)�� = v(A)��
D������ʱ�����������ܶȲ���
��5����Ӧ�ﵽƽ���7 minʱ���ı��������ڵ�9min�ﵽ�µ�ƽ�⣬��ͼ2��������7 min����15 min�����ڴ���ֽ�ϣ�����������£�DŨ���仯ͼ��
���������¶���ƽ��ʱD���ʵ����仯��0.4 mol (������)
�������������ݻ�ѹ��Ϊԭ��һ��(��ʵ��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܻ�óɹ����ǣ� ��
A.�ú��ᾧˮ�Ĵ����ƺͼ�ʯ�ҹ����Ƽ��飻
B.����м����ˮ����������屽
C.�ڱ�����Һ�еμ�����ϡ��ˮ���ְ�ɫ������
D.��ͭ˿�ھƾ����ϼ��Ⱥ�����������ˮ�Ҵ��У�ͭ˿�ָ�ԭ���ĺ�ɫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ƽ��2NO2 (g) ![]() N2O4(g)����H<0���ڲⶨNO2 ��Է�������ʱ�����������н�Ϊ���˵���
N2O4(g)����H<0���ڲⶨNO2 ��Է�������ʱ�����������н�Ϊ���˵���
A.�¶�130�棬ѹǿ3.03��105paB.�¶�25�棬 ѹǿ1.01��105pa
C.�¶�130�棬ѹǿ5.05��104paD.�¶�0�棬 ѹǿ5.05��104pa
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪ij��Һ��ֻ��Na+��CH3COO��H+��OH�������ӡ�ijͬѧ�Ʋ����Һ������Ũ�ȿ������������ֹ�ϵ��
A��c(Na+)>c(CH3COO)>c(OH)>c(H+) B��c(Na+)>c(CH3COO)>c(H+)>c(OH)
C��c(Na+)>c(OH)>c(CH3COO)>c(H+) D��c(CH3COO)>c(Na+)>c(H+)>c(OH)
������Һ��ֻ�ܽ���һ�����ʣ������ʵ�������_________����������Ũ�ȴ�С��ϵ����ȷ���ǣ�����ţ�_____��
����������ϵ��D����ȷ�ģ�����Һ�����ʵĻ�ѧʽ��________��
��������Һ�������ȵĴ�����NaOH��Һ��϶��ɣ�����Һǡ�ó����ԣ�����ǰc(CH3COOH)������>����<����=������ͬ��___________c(NaOH)����Ϻ�c(CH3COO)��c(Na+)�Ĺ�ϵ��c(CH3COO)__________c(Na+)��
��2��Na2S������������Ⱦ�ϡ�����ˮ���е��ؽ����ȡ�
��Na2S��Һ��S2ˮ������ӷ���ʽΪ____________________________________��
�������� | FeS | PbS | CuS | HgS |
Ksp | 6.3��1018 | 1.0��1028 | 6.3��1036 | 1.6��1052 |
������ʱ�������ؽ������ӵ�������ܶȻ��������±���
�������ʵ���Ũ����ͬ��Fe2+��Pb2+��Cu2+��Hg2+�Ļ��ϡ��Һ�У���μ���Na2Sϡ��Һ�����ȳ�����������____����Na2S��Һ������ˮ��Pb2+��ΪʹPb2+������ȫ[c(Pb2+)��1��106mol/L]����Ӧ������Һ��c(S2)��_____mol/L����ӦCu2+(aq)+FeS(s) ![]() Fe2+(aq)+CuS(s)��ƽ�ⳣ��K=_______��
Fe2+(aq)+CuS(s)��ƽ�ⳣ��K=_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ����101kPaʱ��2C(s)��O2(g)=2CO(g)����H����221kJ��mol��1
��ϡ��Һ�У�H��(aq)��OH��(aq)=H2O(l)����H����57.3kJ��mol��1
��H2(g)��![]() O2(g)=H2O(g)����H����241.8kJ��mol��1
O2(g)=H2O(g)����H����241.8kJ��mol��1
��H2O(g)=H2O(l)����H����44.0kJ��mol��1
���н�����ȷ���ǣ�������
A.̼��ȼ���ȴ���110.5kJ��mol��1
B.Ũ������ϡNaOH��Һ��Ӧ����1molˮ���ų�57.3kJ ����
C.������ȼ����Ϊ241.8kJ��mol��1
D.2H2(g)��O2(g)=2H2O(l)�ķ�Ӧ��Ϊ��H��571.6kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com