
2- 4 |


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、燃烧液化气为炒菜提供热量 |
| B、用洗涤精洗去锅碗上的油污 |
| C、牛奶久置变质腐败 |
| D、烧菜用过的铁锅,经放置常出现红棕色斑迹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)>c(H+) |
| C、0.1mol?L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| D、0.1mol?L-1的硫化钠溶液中:c(OH-)=c(H+)>c(HS-)>c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,0.1mol?L-1 CH3COOH溶液的pH=1 |
| B、铅蓄电池在放电过程中,负极质量增加,正极pH减少 |
| C、反应CO2(g)+C(s)═2CO(g)在低温下不能自发进行,则其△H>0 |
| D、常温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
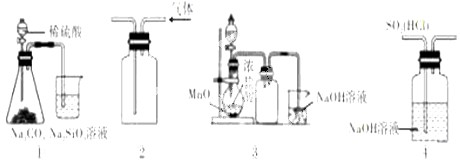
| A、图①实验装置可验证非金属性:S>C>Si |
| B、图②实验装置收集NO2气体 |
| C、图③实验装置可制备、收集Cl2 |
| D、图③实验装置可去除SO2中HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
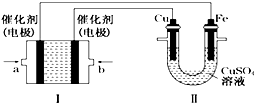 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com