
【题目】一种新型的双离子可充电电池的原理如图所示,以下说法正确的是

A. 电极a发生的反应为还原反应
B. 充电时a极与电源的正极相连
C. 正极发生的电极反应可能为:CaFeO3+e-=CaFeO2.5+1/2O2-
D. 放电时,每当有NA个Na+移向b极,外电路中一定转移2NA个电子
科目:高中化学 来源: 题型:
【题目】异丁酸-3-苯丙酯( )是一种香料,下图是这种香料的一种合成路线:
)是一种香料,下图是这种香料的一种合成路线:

已知以下信息:
①有机物E的摩尔质量为88 g·mol-1,其核磁共振氢谱表明含有3种不同环境的氢原子。
②有机物F是苯甲醇的同系物。
③R—CH==CH2![]() R—CH2CH2OH。
R—CH2CH2OH。
请回答下列问题:
(1)异丁酸-3-苯丙酯的分子式为________________。
(2)A分子中的官能团名称为________________。
(3)C的结构简式为________________。
(4)一定条件下,1 mol D与2 mol H2能够完全反应生成F,D能够发生银镜反应,因此D生成F的反应类型为________________。
(5)E、F反应生成异丁酸-3-苯丙酯的化学方程式为________________________。
(6)已知有机化合物甲符合下列条件:
①与F是同分异构体;②苯环上有3个支链;③核磁共振氢谱显示其含有5种不同环境的氢原子,且不同环境的氢原子个数比为6∶2∶2∶1∶1;④与FeCl3溶液不能发生显色反应。
写出符合上述条件的有机物甲的结构简式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等)中制取硫酸镍晶体的工艺流程如下:

已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42﹣转化为Cr2O72﹣。
③相关物质在不同温度时溶解度如下表:
温度溶解度/g物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为_____。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是_____。
(2)“过滤”前,适当加热的目的是_____。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是_____。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为_____。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,_____,得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前国际空间站处理CO2废气涉及的反应为CO2+4H2 ![]() CH4+2H2O。该反应的下列说法正确的是
CH4+2H2O。该反应的下列说法正确的是
A. 通过使用钌催化剂能使CO2 100%转化为CH4
B. 该温度下,当反应达平衡时,CH4物质的量就不再变化,因为反应已经停止
C. 除了使用催化剂,升高温度或增大压强都能加快该反应的速率
D. 由于升高温度可以加快反应速率,所以在工业生产中该反应温度越高越好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂个数的关系为2∶1的是
A.O3+2KI+H2O=2KOH+I2+O2
B.2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2Ca
C.I2+2NaClO3=2NaIO3+Cl2
D.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O4俗称保险粉,常用做纺织工业的漂白剂、脱色剂等。某科研小组制备并探究其性质。
资料:Na2S2O4易溶于水,具有极强的还原性,易被空气氧化,在碱性介质中稳定。
Ⅰ.制备Na2S2O4 (部分加热等辅助仪器略去)

(1)仪器①的名称是___________。
(2)B装置用于制备Na2S2O4。第一步反应:Zn+2SO2![]() ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为___________。
ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为___________。
(3)实验时,先向B中通入SO2的原因,除产生Zn S2O4之外,另一原因是___________。
(4)反应后除去B中的沉淀,在滤液中加入一定量的NaCl固体搅拌,有Na2S2O4晶体析出。加入NaCl固体的作用是___________
Ⅱ.探究Na2S2O4的性质
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是___________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4,溶液)
(6)制备纳米级银粉用NaOH溶液溶解Na2S2O4,加入一定量的AgNO3溶液,生成纳米级的银粉。在制备银粉的反应中,氧化剂和还原剂的物质的量之比为2:1,且生成的含硫物质只有一种,写出该反应的离子方程式___________。
(7)为测定某含硫代硫酸钠样品的纯度(其它杂质均不参加反应)设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品mg,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入少量淀粉溶液,用 nmol·L-1I2标准溶液滴定(发生反应:2S2O32-+I2=S4O32-+2I-),至滴定终点。
③滴定终点的现象为___________,平均消耗I2标准溶液VmL,样品中Na2S2O4的纯度为___________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
D. 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/( L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛。在压强为30 MPa时,合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是__________________________________________________。
(2)根据下图,合成氨的热化学方程式是__________________________。
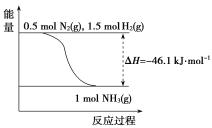
(3)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量________92.2 kJ(填“大于”“等于”或“小于”),原因是________________________;若加入催化剂,ΔH________(填“变大”“变小”或“不变”)。
(4)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(5)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:


(1)实验装置中,仪器c的名称为________________,作用为_______________。
(2)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了_______气体。继续滴加至液溴滴完。写出a中发生反应的化学方程式:_________________________________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是____________________________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入无水氯化钙的目的是_______________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为____________,要进一步提纯,需进行的操作方法为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com