
【题目】氨在工农业生产中应用广泛。在压强为30 MPa时,合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是__________________________________________________。
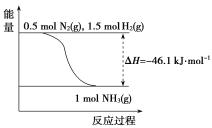
(2)根据下图,合成氨的热化学方程式是__________________________。
(3)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量________92.2 kJ(填“大于”“等于”或“小于”),原因是________________________;若加入催化剂,ΔH________(填“变大”“变小”或“不变”)。
(4)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(5)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为____________________。
【答案】温度升高,氨在混合气体中的体积分数减小,平衡逆向移动,温度升高平衡向着吸热反应方向移动,故正反应是放热反应 N2(g)+3H2(g) ==2NH3(g)ΔH=-92.2 kJ·mol-1 小于 由于该反应是可逆反应,反应物无法全部转化为生成物 不变 391 N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1
【解析】
(1)由表格中的数据可以知道温度升高,合成氨平衡混合气体中氨气的体积分数减少,说明平衡逆向移动,而温度升高,平衡向吸热的方向移动;
(2)由图可以知道1/2molN2(g),3/2mol H2(g) 完全反应生成1molNH3(g) 的反应热为-46.1kJ·mol-1,据此写出合成氨的热化学反应方程式;
(3)合成氨的反应为可逆反应,反应物无法全部转化为生成物;
(4)根据反应热=反应物断键吸收的总能量-生成物成键放出的总能量进行计算;
(5)根据盖斯定律进行计算。
(1)由表格数据可以知道温度升高,合成氨平衡混合气体中氨气的体积分数减少,说明平衡逆向移动,而温度升高,平衡向吸热的方向移动,则合成氨反应是放热反应;
因此,本题正确答案是: 温度升高,氨在混合气体中的体积分数减小,平衡逆向移动,温度升高平衡向着吸热反应方向移动,故正反应是放热反应。
(2)由图可以知道1/2molN2(g),3/2mol H2(g) 完全反应生成1molNH3(g) 的反应热为-46.1kJ·mol-1,所以合成氨的热化学反应方程式为: N2(g)+3H2(g) ==2NH3(g)ΔH=-92.2 kJ·mol-1;
综上所述,本题答案是:N2(g)+3H2(g) ==2NH3(g)ΔH=-92.2 kJ·mol-1。
(3) 在一密闭容器中,合成氨的反应为可逆反应,反应物无法全部转化为生成物,所以取1mol N2(g)和3mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量小于92.2 kJ;若加入催化剂,能够加快反应速率,但不影响反应热,ΔH不变;综上所述,本题答案是:小于;由于该反应是可逆反应,反应物无法全部转化为生成物;不变。
(4)N2(g)+3H2(g) ==2NH3(g)ΔH=-92.2 kJ·mol-1,则破坏1molN—H键需要吸收的能量为xkJ,根据反应热=反应物断键吸收的总能量-生成物成键放出的总能量可知,-92.2=946+3×436-2×3×x,x=391kJ;综上所述,本题答案是:391。
(5)①N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1,②N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1,根据盖斯定律可知,②×2-①可知,2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g) ΔH=-534×2-67.7=-1135.7 kJ·mol-1;所以1mol N2H4与NO2完全反应的热化学方程式为N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1;综上所述,本题答案是:N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g) ![]() CH3OH(g),现在实验室模拟该反应并进行分析。
CH3OH(g),现在实验室模拟该反应并进行分析。
(1)下图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示
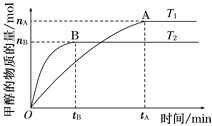
下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=nA/tAmol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(3)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的双离子可充电电池的原理如图所示,以下说法正确的是

A. 电极a发生的反应为还原反应
B. 充电时a极与电源的正极相连
C. 正极发生的电极反应可能为:CaFeO3+e-=CaFeO2.5+1/2O2-
D. 放电时,每当有NA个Na+移向b极,外电路中一定转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗血栓药物氯贝丁酯( )的一种合成路线如下图,部分反应条件及部分反应物、生成物已略去。
)的一种合成路线如下图,部分反应条件及部分反应物、生成物已略去。

回答下列问题:
(1)E中官能团的名称为___________。
(2)有机物A的化学名称为___________,B的结构简式为___________,反应Ⅱ的反应类型为___________。
(3)要实现反应I的转化,加入下列物质能达到目的的是___________。
A. NaHCO. B NaOH C. Na2CO3 D. CH3COONa
(4)写出反应Ⅲ的化学方程式_________________________________。
(5)产物E有多种同分异构体,满足下列条件的所有同分异构体G有___________种。
①属于酯类且与FeCl3溶液显紫色:②能发生银镜反应;③1molG最多与2 molNaOH反应;④苯环上只有2个取代基且处于对位。
(6)结合以上合成路线信息,设计以 CH3CH2 COOH为原料(无机试剂任选),合成有机物 的合成路线_______________________________。
的合成路线_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol/L弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知![]() ,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是
,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是

A. 图中M、N两点对应溶液中的c(OH-)比较:前者>后者
B. 丙酸的电离常数K=10-4.88
C. 等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者>后者
D. 将0.1 mol/L的HCOOH溶液与0.1 mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,在仪器①②③中分别依次加入下列各选项中所对应的试剂进行实验,能达到实验目的的是

A. 浓盐酸、浓硫酸、浓硫酸,制取干燥的氯化氢气体
B. 浓盐酸、二氧化锰、饱和食盐水,制取纯浄的氯气
C. 稀硫酸、溶液X、澄清石灰水,检验溶液X中是否含有CO32—
D. 浓盐酸、碳酸钙、水玻璃,验证盐酸、碳酸、硅酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VmLFe2(SO4)3溶液中含有Fe3+ag,取![]() mL溶液稀释到5VmL,则稀释后溶液中SO42﹣的物质的量浓度是
mL溶液稀释到5VmL,则稀释后溶液中SO42﹣的物质的量浓度是
A.![]() mol/LB.
mol/LB.![]() mol/L
mol/L
C.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在0.1mol/L的草酸(H2C2O4)溶液中加入等浓度的NaOH溶液,H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的变化如图所示。下列说法不正确的是

A. 反应过程中c(H2C2O4)+c(HC2O4-)+c(C2O42-)<0.1mol/L
B. lg[K1(H2C2O4)]=-1.2
C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
D. 当NaOH溶液与H2C2O4溶液体积之比为3:2时,2c(Na+)+c(OH-)=2c(H2C2O4)+c(HC2O4-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-x FePO4![]() LiFePO4+6C。下列说法正确的是
LiFePO4+6C。下列说法正确的是

A. 放电时Li+从左边移向右边,PO43-从右边移向左边
B. 放电时,正极反应式为:Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时M极连接电源的负极,电极反应为6C+xe-=C6x-
D. 充电时电路中通过2.0mol电子,产生7.0gLi
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com