
【题目】VmLFe2(SO4)3溶液中含有Fe3+ag,取![]() mL溶液稀释到5VmL,则稀释后溶液中SO42﹣的物质的量浓度是
mL溶液稀释到5VmL,则稀释后溶液中SO42﹣的物质的量浓度是
A.![]() mol/LB.
mol/LB.![]() mol/L
mol/L
C.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
科目:高中化学 来源: 题型:
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等)中制取硫酸镍晶体的工艺流程如下:

已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42﹣转化为Cr2O72﹣。
③相关物质在不同温度时溶解度如下表:
温度溶解度/g物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为_____。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是_____。
(2)“过滤”前,适当加热的目的是_____。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是_____。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为_____。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,_____,得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
D. 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/( L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛。在压强为30 MPa时,合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是__________________________________________________。
(2)根据下图,合成氨的热化学方程式是__________________________。
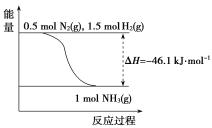
(3)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量________92.2 kJ(填“大于”“等于”或“小于”),原因是________________________;若加入催化剂,ΔH________(填“变大”“变小”或“不变”)。
(4)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(5)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为____________mol·L-1·s-1;反应的平衡常数K1为________。

(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是______________。
②列式计算温度T时反应的平衡常数K2________________________。
(3)温度T时反应达第一次平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,达到新的平衡后与第一次平衡相对比:颜色____________(填“变深”或“变浅”或“不变”),c(NO2)/c(N2O4)的值_______ (填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.l0mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 室温下,欲使0.1mol/L醋酸溶液的pH,电离度a都减小,可加入少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素A、B、C、D、E的原子序数依次增加,五种元素中C的原子半径最大,B与E同主族,D的氧化物既能与酸反应也能与碱反应,E的氧化物是形成酸雨的主要原因,A与E形成的化合物是下水道中具有特殊气味的气体。下列说法正确的是
A. 1molA2B2中所含的共用电子对数目为3NA
B. A2E水溶液的电离方程式为A2E![]() 2A++E2-
2A++E2-
C. 最高价氧化物对应的水化物的酸性:D>E
D. 简单氢化物的热稳定性:B>E,是因为B的氢化物分子间含有氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:


(1)实验装置中,仪器c的名称为________________,作用为_______________。
(2)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了_______气体。继续滴加至液溴滴完。写出a中发生反应的化学方程式:_________________________________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是____________________________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入无水氯化钙的目的是_______________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为____________,要进一步提纯,需进行的操作方法为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,体积为6.72L的CO质量为___,CO物质的量为____,CO分子数为____,CO摩尔质量为____。
(2)在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4g。CO的质量为____g。CO的体积为___L。混合气体的平均摩尔质量为___g·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com