
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为____________mol·L-1·s-1;反应的平衡常数K1为________。

(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是______________。
②列式计算温度T时反应的平衡常数K2________________________。
(3)温度T时反应达第一次平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,达到新的平衡后与第一次平衡相对比:颜色____________(填“变深”或“变浅”或“不变”),c(NO2)/c(N2O4)的值_______ (填“增大”、“减小”或“不变”)
【答案】大于 0.0010 0.36 mol·L-1 大于 反应正方向吸热,反应向吸热方向进行,故温度升高 平衡时,c(NO2)=0.120 mol·L-1+0.0020 mol·L-1·s-1×10 s×2=0.16 mol·L-1,c(N2O4)=0.040 mol·L-1-0.0020 mol·L-1·s-1×10 s=0.020 mol·L-1,K2=1.3 mol·L-1 逆反应 变深 减小
【解析】
(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;根据0~60s时段,N2O4浓度变化情况可以求出v(N2O4);根据图像中的数据,可以求出平衡常数K;
(2)①N2O4(g)![]() 2NO2(g),△H>0,升温,平衡右移,c(N2O4) 降低;根据c=v(N2O4)×t,可以求出N2O4气体、NO2气体变化的浓度,然后根据第二次反应达平衡时,求出总c(NO2)、c(N2O4),进而求出K2;
2NO2(g),△H>0,升温,平衡右移,c(N2O4) 降低;根据c=v(N2O4)×t,可以求出N2O4气体、NO2气体变化的浓度,然后根据第二次反应达平衡时,求出总c(NO2)、c(N2O4),进而求出K2;
(3)反应容器的容积减少一半,压强增大,平衡向着气体体积减小的方向移动,判断c(NO2)/c(N2O4)的值变化情况;体积减小造成气体的浓度增大是主要因素,所以混合气体的颜色加深。
(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;在0~60 s时段,N2O4浓度变化为0.1-0.04=0.06mol/L,反应速率v(N2O4)为=0.06/60=0.0010 mol·L-1·s-1;根据图像中的数据可知,反应的平衡常数K=c2(NO2)/c(N2O4)=0.122/0.04=0.36 mol·L-1;
综上所述,本题答案是:大于,0.0010,0.36 mol·L-1。
(2)①c(N2O4) 降低,平衡向正反应方向移动,因为正反应方向吸热,T大于100 ℃;
综上所述,本题答案是:大于;反应正方向吸热,反应向吸热方向进行,故温度升高。
②反应达到平衡时,c(NO2)=0.120 mol·L-1+0.0020 mol·L-1·s-1×10 s×2=0.16 mol·L-1,c(N2O4)=0.040 mol·L-1-0.0020 mol·L-1·s-1×10 s=0.020 mol·L-1,K2=c2(NO2)/c(N2O4)=0.162/0.02≈1.3 mol·L-1 ;
综上所述,本题答案是:平衡时,c(NO2)=0.120 mol·L-1+0.0020 mol·L-1·s-1×10 s×2=0.16 mol·L-1,c(N2O4)=0.040 mol·L-1-0.0020 mol·L-1·s-1×10 s=0.020 mol·L-1,K2=1.3 mol·L-1 。
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,即平衡向逆反应方向移动;由于气体体积减小,造成气体的浓度增大的影响比平衡左移造成NO2(g)浓度减小的影响要大,所以达到新的平衡后与第一次平衡相对比颜色变深;由于平衡左移,c(NO2)减小,c(N2O4)增大,所以c(NO2)/c(N2O4)的值减小;
综上所述,本题答案是:逆反应, 变深,减小。


科目:高中化学 来源: 题型:
【题目】下列有关事实,与水解反应无关的是
A. 热的纯碱溶液用于清洗油污
B. 氯化铁溶液腐蚀铜板
C. 加热蒸干氯化铁溶液,不能得到氯化铁晶体
D. 用TiCl4和大量水反应,同时加热制备TiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡状态标志的是①单位时间内生成a mol A,同时生成3a mol B;②C生成的速率与C分解的速率相等; ③A、B、C的浓度不再变化;④A、B、C的压强不再变化;⑤混合气体的总压强不再变化;⑥A、B、C的分子数之比为1∶3∶2⑦单位时间内消耗a mol A,同时生成3a mol B;⑧混合气体的物质的量不再变化;
2C(g)达到平衡状态标志的是①单位时间内生成a mol A,同时生成3a mol B;②C生成的速率与C分解的速率相等; ③A、B、C的浓度不再变化;④A、B、C的压强不再变化;⑤混合气体的总压强不再变化;⑥A、B、C的分子数之比为1∶3∶2⑦单位时间内消耗a mol A,同时生成3a mol B;⑧混合气体的物质的量不再变化;
A. ②⑧ B. ①⑥ C. ②④ D. ③⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol/L弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知![]() ,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是
,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是

A. 图中M、N两点对应溶液中的c(OH-)比较:前者>后者
B. 丙酸的电离常数K=10-4.88
C. 等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者>后者
D. 将0.1 mol/L的HCOOH溶液与0.1 mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
硼元素对植物生长及人体健康有着十分重要的作用,硼的化合物被广泛应用于新材料制备、生活生产等诸多领域。
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
A.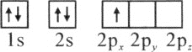
B.
C.
D.
(2)晶体硼单质能自发呈现出正二十面体的多面体外形,这种性质称为晶体的________。
(3)硼元素的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。
①H3BO3晶体中单元结构如图Ⅰ所示。各单元中的氧原子通过________氢键(用“A—B…C”表示,A、B、C表示原子)连结成层状结构,其片层结构如图Ⅱ所示,层与层之间以________(填作用力名称)相结合构成整个硼酸晶体。

②硼氢化钠中![]() 的键角大小是________,立体构型为________。
的键角大小是________,立体构型为________。
③根据上述结构判断下列说法正确的是________
a.H3BO3分子的稳定性与氢键有关
b.硼酸晶体有滑腻感,可作润滑剂
c.H3BO3分子中硼原子最外层为8e-稳定结构
d.含1mol H3BO3的晶体中有3 mol氢键
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是________;已知晶胞边长为a pm,则磷化硼晶体的密度是________g·cm-3(列出含a、NA的计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VmLFe2(SO4)3溶液中含有Fe3+ag,取![]() mL溶液稀释到5VmL,则稀释后溶液中SO42﹣的物质的量浓度是
mL溶液稀释到5VmL,则稀释后溶液中SO42﹣的物质的量浓度是
A.![]() mol/LB.
mol/LB.![]() mol/L
mol/L
C.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)xC(g),有图 I(T表示温度,P 表示压强,C%表示 C 的体积分数)所示的反应曲线,试判断对图 II 的说法中正确的是

A. 若 P3>P4,则 y 轴表示 B 的百分含量
B. 若 P3>P4,则 y 轴表示混合气体的平均摩尔质量
C. 若 P3<P4,则 y 轴表示 B 的体积分数
D. 若 P3<P4,则 y 轴表示混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(主要成分是CuFeS2)为原料炼铜的方法为火法炼铜和湿法炼铜两种。
(1)火法炼铜时产生大量SO2,根据原电池原理,稀硫酸作电解质溶液,使用惰性电极,一极通入SO2,另一极通入O2,治理SO2污染,负极反应的离子方程式为___________________________。
(2)火法炼铜的过程中,电解出铜制备精铜时产生的废电解液中含有较多Ni2+和Pb2+,从废电解液中除去Pb2+的方法是往其中通入H2S至饱和,使Pb2+转化为硫化物沉淀(已知饱和H2S溶液中c(H2S)为0.1mol/L,![]() ≈10-20;Ksp(NiS)≈10-11)。若废电解液的pH=5,为保证不生成沉淀,Ni2+浓度应控制在_________mol/L以下。
≈10-20;Ksp(NiS)≈10-11)。若废电解液的pH=5,为保证不生成沉淀,Ni2+浓度应控制在_________mol/L以下。
(3)近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐。某工厂运用该原理生产铜和绿矾(FeSO4·7H2O)的工艺如图:

①写出反应的化学反应方程式:___________________________;如果对该反应进行高温加热,发现化学反应速率降低乃至反应停止,请简述理由:___________________________。
②固体A的成分为___________________________。
③欲从滤液中获得绿矾晶体,分离操作I因为_________、_________、过滤。
④写出反应湿法炼铜的化学反应方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现有一包NaCl、FeCl3、Al2(SO4)3组成的粉末,某课外小组同学为测定其中NaCl的含量,取13.69 g样品进行如下实验(所加试剂均为过量)。

请回答:
(1)①~③所涉及的实验操作方法中,用到过滤的是______(填序号)。
(2)生成沉淀C的离子方程式是_________________________________。
(3)根据上述实验,判断下列说法正确的是______(填字母)。
a.溶液D是无色的碱性溶液
b.溶液D中至少含有5种离子
c.向溶液D中加入过量稀硫酸,产生白色沉淀
d.仅用硝酸银一种试剂不能检验溶液D中的氯离子
(4)样品中NaCl的物质的量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com