
【题目】实验室现有一包NaCl、FeCl3、Al2(SO4)3组成的粉末,某课外小组同学为测定其中NaCl的含量,取13.69 g样品进行如下实验(所加试剂均为过量)。

请回答:
(1)①~③所涉及的实验操作方法中,用到过滤的是______(填序号)。
(2)生成沉淀C的离子方程式是_________________________________。
(3)根据上述实验,判断下列说法正确的是______(填字母)。
a.溶液D是无色的碱性溶液
b.溶液D中至少含有5种离子
c.向溶液D中加入过量稀硫酸,产生白色沉淀
d.仅用硝酸银一种试剂不能检验溶液D中的氯离子
(4)样品中NaCl的物质的量为______。
【答案】②③ Fe3+ + 3OH - = Fe(OH)3 ↓ abcd 0.12mol
【解析】
NaCl、FeCl3、Al2(SO4)3组成的粉末加入水中溶解后,加入氯化钡溶液沉淀硫酸根离子得到沉淀B为BaSO4,溶液A为氯化钠、氯化铁、氯化铝、剩余的氯化钡混合液,加入试剂X为过量氢氧化钠溶液,生成沉淀C为氢氧化铁,加热分解生成氧化铁质量为1.60g,溶液D为偏铝酸钠和氯化钠溶液、剩余的氢氧化钠溶液、剩余的氯化钡溶液;
(1)根据流程分析判断,实验操作②③用过滤操作;
(2)沉淀C为氢氧化铁;
(3)溶液D为氯化钠、偏铝酸钠、过量的氢氧化钠、过量的氯化钡溶液分析判断;
(4)根据硫酸根离子守恒和铁元素守恒计算硫酸铝和氯化铁的质量得到原物质中氯化钠的质量。
NaCl、FeCl3、Al2(SO4)3组成的粉末加入水中溶解后,加入氯化钡溶液沉淀硫酸根离子得到沉淀B为BaSO4,溶液A为氯化钠、氯化铁、氯化铝、剩余的氯化钡混合液,加入试剂X为过量氢氧化钠溶液,生成沉淀C为氢氧化铁,加热分解生成氧化铁质量为1.60g,溶液D为偏铝酸钠和氯化钠溶液、剩余的氢氧化钠溶液、剩余的氯化钡溶液;
(1)根据流程分析判断,固体与液体分离的实验操作是过滤,②③用过滤操作;
因此,本题正确答案是: ②③。
(2)沉淀C为氢氧化铁,反应的离子方程式为: Fe3+ + 3OH - = Fe(OH)3 ↓;
因此,本题正确答案是: Fe3+ + 3OH - = Fe(OH)3 ↓。
(3)溶液D为氯化钠、偏铝酸钠、过量的氢氧化钠、过量氯化钡溶液,
a.溶液D中含有氯化钠、偏铝酸钠、氢氧化钠、氯化钡,是无色的碱性溶液,故a正确;
b.溶液D中含有氯化钠、偏铝酸钠、氢氧化钠,氯化钡,含有离子Na+、Cl-、AlO2-、OH-、H+、Ba2+,至少含有5种离子,故b正确;
c.溶液D中含有氯化钠、偏铝酸钠、氢氧化钠、氯化钡,加入过量稀硫酸,产生白色沉淀硫酸钡沉淀,故c正确;
d.溶液中含有硫酸根和氯离子,硫酸银和氯化银均为白色沉淀,仅用硝酸银一种试剂不能检验溶液D中的氯离子,故d正确;
因此,本题正确答案是:abcd。
(4)根据硫酸根离子守恒和铁元素守恒计算硫酸铝和氯化铁的质量得到原物质中氯化钠的质量:加入氯化钡溶液沉淀硫酸根离子得到沉淀B为BaSO4,n(Al2(SO4)3)=1/3n(BaSO4)=1/3×6.99g÷233g/mol=0.01mol,n(FeCl3)=2n(Fe2O3)=2×1.60g÷160g/mol=0.02mol,所以混合物中氯化钠质量=13.69g-0.01mol×342g/mol+0.02mol×162.5g/mol=7.02g,氯化钠的物质的量为:7.02g÷58.5g/mol=0.12mol;
因此,本题正确答案是:0.12mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为____________mol·L-1·s-1;反应的平衡常数K1为________。

(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是______________。
②列式计算温度T时反应的平衡常数K2________________________。
(3)温度T时反应达第一次平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,达到新的平衡后与第一次平衡相对比:颜色____________(填“变深”或“变浅”或“不变”),c(NO2)/c(N2O4)的值_______ (填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2的结构如下图:

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,试回答:
(1)写出H2O2分子的电子式和结构式。___________
(2)写出分子内的键型。__________
(3)估计它难溶于CS2,简要说明原因。_________
(4)指出氧元素的化合价,简要说明原因。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Y元素在同周期中离子半径最小;甲、乙分别是元素Y、Z的单质;丙、丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态;戊为酸性气体,常温下0.01mol·L-1戊溶液的pH大于2。上述物质转化关系如图所示。下列说法正确的是
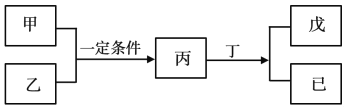
A. 原子半径:Z>Y>X>W
B. W、X、Y、Z不可能同存于一种离子化合物中
C. W和Ⅹ形成的化合物既可能含有极性键也可能含有非极性键
D. 比较X、Z非金属性强弱时,可比较其最高价氧化物对应的水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,体积为6.72L的CO质量为___,CO物质的量为____,CO分子数为____,CO摩尔质量为____。
(2)在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4g。CO的质量为____g。CO的体积为___L。混合气体的平均摩尔质量为___g·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是

A. C3N4中C的化合价为 -4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是

A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法正确的是
A. 煤经过气化、液化等一系列物理变化可转变为清洁燃料
B. 用植物秸秆造纸并将废水通过高压水井压到地下,可节约能源
C. 食品袋内活性炭粉、活性铁粉和![]() 组成的混合物作除氧剂和干燥剂
组成的混合物作除氧剂和干燥剂
D. 华为手机![]() 外壳上贴的碳纤维膜是一种新型有机高分子材料
外壳上贴的碳纤维膜是一种新型有机高分子材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com