
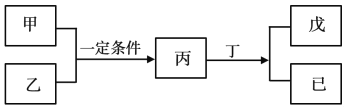
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Y元素在同周期中离子半径最小;甲、乙分别是元素Y、Z的单质;丙、丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态;戊为酸性气体,常温下0.01mol·L-1戊溶液的pH大于2。上述物质转化关系如图所示。下列说法正确的是
A. 原子半径:Z>Y>X>W
B. W、X、Y、Z不可能同存于一种离子化合物中
C. W和Ⅹ形成的化合物既可能含有极性键也可能含有非极性键
D. 比较X、Z非金属性强弱时,可比较其最高价氧化物对应的水化物的酸性
【答案】C
【解析】
Y元素在同周期中离子半径最小,金属离子外的电子层数比相应的原子少一层,而且同周期金属元素离子半径随着原子序数的递增而减小,而非金属元素的离子的电子层没有减少,所以Y应为Al元素。丁为二元化合物,而且为液态,为水。丙与水反应得到两种物质,而且一种为酸。0.01mol·L-1戊溶液的pH大于2,为弱酸。短周期中二元化合物为弱酸的HF和H2S。结合乙是Z的单质,Z的原子序数比Al大,Z为S元素。涉及的反应为2Al+3S![]() Al2S3,Al2S3+6H2O=2Al(OH)3+3H2S↑。W、X、Y、Z分别为H、O、Al、S。
Al2S3,Al2S3+6H2O=2Al(OH)3+3H2S↑。W、X、Y、Z分别为H、O、Al、S。
A.H原子半径最小。同周期的元素,原子序数越大,原子半径越小,Al原子的半径大于S;同主族元素,原子序数越大,原子半径越大,S的原子半径大于O,排序为Y(Al)> Z(S)> X(O)> W(H),A项错误;
B.H、O、Al、S可以存在于KAl(SO4)2·12H2O中,存在离子键,为离子化合物,B项错误;
C.W(H)和X(O)的化合物可能为H2O和H2O2。H2O的结构简式为H—O—H,含有极性键。H2O2的结构简式为H—O-O—H,含有极性键和非极性键,C项正确;
D.比较X(O)和Z(S)的非金属性,不能比较最高价氧化物对应的水化物的酸性,因为O没有它的含氧酸。D项错误;
本题答案选C。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol/L弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知![]() ,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是
,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是

A. 图中M、N两点对应溶液中的c(OH-)比较:前者>后者
B. 丙酸的电离常数K=10-4.88
C. 等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者>后者
D. 将0.1 mol/L的HCOOH溶液与0.1 mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(主要成分是CuFeS2)为原料炼铜的方法为火法炼铜和湿法炼铜两种。
(1)火法炼铜时产生大量SO2,根据原电池原理,稀硫酸作电解质溶液,使用惰性电极,一极通入SO2,另一极通入O2,治理SO2污染,负极反应的离子方程式为___________________________。
(2)火法炼铜的过程中,电解出铜制备精铜时产生的废电解液中含有较多Ni2+和Pb2+,从废电解液中除去Pb2+的方法是往其中通入H2S至饱和,使Pb2+转化为硫化物沉淀(已知饱和H2S溶液中c(H2S)为0.1mol/L,![]() ≈10-20;Ksp(NiS)≈10-11)。若废电解液的pH=5,为保证不生成沉淀,Ni2+浓度应控制在_________mol/L以下。
≈10-20;Ksp(NiS)≈10-11)。若废电解液的pH=5,为保证不生成沉淀,Ni2+浓度应控制在_________mol/L以下。
(3)近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐。某工厂运用该原理生产铜和绿矾(FeSO4·7H2O)的工艺如图:

①写出反应的化学反应方程式:___________________________;如果对该反应进行高温加热,发现化学反应速率降低乃至反应停止,请简述理由:___________________________。
②固体A的成分为___________________________。
③欲从滤液中获得绿矾晶体,分离操作I因为_________、_________、过滤。
④写出反应湿法炼铜的化学反应方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a,b,c,d为四种由短周期元素构成的中性粒子,它们都有14个电子,且除a外都是共价型分子。回答下列问题:
(1)a是单核粒子,a单质可用作半导体材料,a原子核外电子排布式为______________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为__________而中毒。
(3)c是双核单质,写出其电子式____________。c分子中所含共价键的类型为_______(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是________________________。
(4)d是四核化合物,其结构式为______________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ___π(填“>”、“<”或“=”),原因是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种免疫调节剂,其结构简式如图所示,关于该物质的说法不正确的是
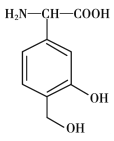
A. 属于芳香族化合物,分子式为C9H11O4N
B. 可以发生的反应类型有:加成反应、取代反应、氧化反应、聚合反应
C. 分子中所有碳原子有可能在同一平面上
D. 1mol该调节剂最多可以与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-x FePO4![]() LiFePO4+6C。下列说法正确的是
LiFePO4+6C。下列说法正确的是

A. 放电时Li+从左边移向右边,PO43-从右边移向左边
B. 放电时,正极反应式为:Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时M极连接电源的负极,电极反应为6C+xe-=C6x-
D. 充电时电路中通过2.0mol电子,产生7.0gLi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现有一包NaCl、FeCl3、Al2(SO4)3组成的粉末,某课外小组同学为测定其中NaCl的含量,取13.69 g样品进行如下实验(所加试剂均为过量)。

请回答:
(1)①~③所涉及的实验操作方法中,用到过滤的是______(填序号)。
(2)生成沉淀C的离子方程式是_________________________________。
(3)根据上述实验,判断下列说法正确的是______(填字母)。
a.溶液D是无色的碱性溶液
b.溶液D中至少含有5种离子
c.向溶液D中加入过量稀硫酸,产生白色沉淀
d.仅用硝酸银一种试剂不能检验溶液D中的氯离子
(4)样品中NaCl的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列路线合成新抗凝(抗血栓药物)
新抗凝

已知:I:
II:
III:![]()
(1) 所需的试剂是__________。
所需的试剂是__________。
(2) B→C分两步进行,反应类型分别是 __________、__________。
(3)下列说法不正确的是_________。
a.化合物B能使Br2/CCl4褪色
b. 化合物C能发生银镜反应
c.F遇FeCl3溶液显色
d. 新抗凝的分子式C19H15NO6
(4)E+H→新抗凝的化学方程式是_______________________。
(5)已知:![]() ,写出有关化合物的结构简式I ________F________G________。
,写出有关化合物的结构简式I ________F________G________。
(6)写出一种符合下列条件的A的同分异构体的结构简式_____________________。
① 红外光谱表明分子中含有-COO-、苯环结构
② 1H-NMR谱显示苯环上有三种不同环境的H原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到.OPA是一种重要的有机化工中间体,A、B、C、D、E、F和OPA的转化关系如下所示:

已知:![]()
回答下列问题:
(1)A的化学名称是___________,由A生成B的反应类型是___________。
(2)写出任意一种C的可能的结构简式___________。
(3)D(邻苯二甲酸二乙酯)是一种增塑剂。由A可以经过两步合成D,②反应的方程式为___________。
(4)OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F反应的化学方程式为___________。一种新型可降解聚碳酸酯塑料,可由OPA的一种还原产物与碳酸二甲酯在一定条件下,通过缩聚反应制得,该聚酯的结构简式为___________。
(5)芳香化合物G是E的同分异构体,G遇FeCl3显紫色,能发生水解反应,且一定条件下可以发生银镜反应,满足以上条件的G的同分异构体有___________种。
(6)参照上述合成路线,请设计由乙烯为起始原料制备聚合物![]() 的合成路线,(无机试剂任选)____________________________________________。
的合成路线,(无机试剂任选)____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com