
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到.OPA是一种重要的有机化工中间体,A、B、C、D、E、F和OPA的转化关系如下所示:

已知:![]()
回答下列问题:
(1)A的化学名称是___________,由A生成B的反应类型是___________。
(2)写出任意一种C的可能的结构简式___________。
(3)D(邻苯二甲酸二乙酯)是一种增塑剂。由A可以经过两步合成D,②反应的方程式为___________。
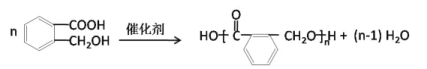
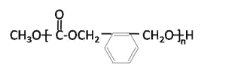
(4)OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F反应的化学方程式为___________。一种新型可降解聚碳酸酯塑料,可由OPA的一种还原产物与碳酸二甲酯在一定条件下,通过缩聚反应制得,该聚酯的结构简式为___________。
(5)芳香化合物G是E的同分异构体,G遇FeCl3显紫色,能发生水解反应,且一定条件下可以发生银镜反应,满足以上条件的G的同分异构体有___________种。
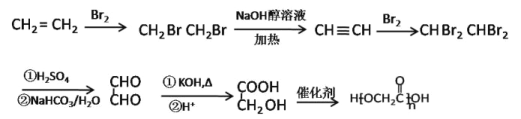
(6)参照上述合成路线,请设计由乙烯为起始原料制备聚合物![]() 的合成路线,(无机试剂任选)____________________________________________。
的合成路线,(无机试剂任选)____________________________________________。
【答案】邻二甲苯(或1,2-二甲苯) 取代 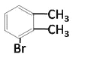 或
或 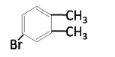
![]()
 13
13 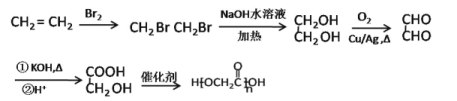
【解析】
A分子式为C8H10,且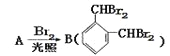 可推知A是
可推知A是![]() ,
,![]() 用Fe作催化剂的条件下与溴发生苯环上的取代反应生成C;
用Fe作催化剂的条件下与溴发生苯环上的取代反应生成C;![]() 先用酸性KMnO4将邻二甲苯氧化为邻苯二甲酸,然后再与乙醇发生酯化反应制得邻苯二甲酸二乙酯;
先用酸性KMnO4将邻二甲苯氧化为邻苯二甲酸,然后再与乙醇发生酯化反应制得邻苯二甲酸二乙酯;![]()
![]()
![]() ,
,![]() 发生缩聚反应生成高聚物
发生缩聚反应生成高聚物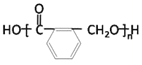 。
。
(1)由合成路线图知:芳香化合物A分子式为C8H10,且 可推知A是
可推知A是![]() ,名称为邻二甲苯;A→B的反应是
,名称为邻二甲苯;A→B的反应是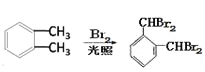 ,为取代反应;
,为取代反应;
(2) A→C(C8H9Br),条件是Br2/FeBr3,可知发生的是苯环上的取代,![]() 苯环上有2种等效氢,则C的可能结构简式有两种分别是:
苯环上有2种等效氢,则C的可能结构简式有两种分别是: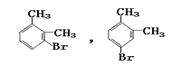 ;
;
(3)D为邻苯二甲酸二乙酯,A→D经两步合成,可先用酸性KMnO4将邻二甲苯氧化为邻苯二甲酸,然后再与乙醇发生酯化反应制得。反应②的方程式是![]() ;
;
(4) OPA→E(C8H8O3),结合题给信息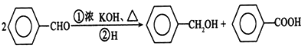 ,可知在此条件下-CHO即可被氧化为-COOH又能被还原为-CH2OH,所以中间体E的结构简式为:
,可知在此条件下-CHO即可被氧化为-COOH又能被还原为-CH2OH,所以中间体E的结构简式为:![]() ,该有机物因有-COOH和-OH两种官能团,则可发生缩聚反应合成一种聚酯类高分子F,其反应为
,该有机物因有-COOH和-OH两种官能团,则可发生缩聚反应合成一种聚酯类高分子F,其反应为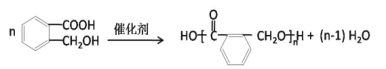 。OPA的还原产物为
。OPA的还原产物为![]() 与碳酸二甲酯(
与碳酸二甲酯(![]() )在一定条件下,通过缩聚反应聚酯
)在一定条件下,通过缩聚反应聚酯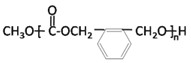 ;
;
(5)芳香化合物G是E的同分异构体,G遇FeCl3显紫色,说明含有酚羟基,能发生水解反应,且一定条件下可以发生银镜反应,说明含有HCOO-,满足条件的![]() 的同分异构体,苯环上若有2个取代基:-OH、HCOOCH2-,有邻间对三种结构;苯环上若有3个取代基:-OH、HCOO-、CH3-,有10种结构,共有13种。
的同分异构体,苯环上若有2个取代基:-OH、HCOOCH2-,有邻间对三种结构;苯环上若有3个取代基:-OH、HCOO-、CH3-,有10种结构,共有13种。
(6)乙烯与溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷水解为乙二醇,乙二醇催化氧化为OHC-CHO,OHC-CHO![]() HOCH2-COOH,HOCH2-COOH缩聚为
HOCH2-COOH,HOCH2-COOH缩聚为![]() ,合成路线为
,合成路线为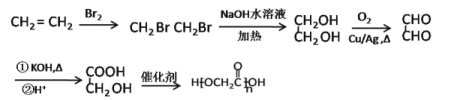 。
。


科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Y元素在同周期中离子半径最小;甲、乙分别是元素Y、Z的单质;丙、丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态;戊为酸性气体,常温下0.01mol·L-1戊溶液的pH大于2。上述物质转化关系如图所示。下列说法正确的是
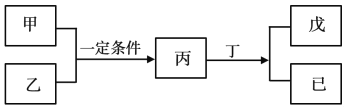
A. 原子半径:Z>Y>X>W
B. W、X、Y、Z不可能同存于一种离子化合物中
C. W和Ⅹ形成的化合物既可能含有极性键也可能含有非极性键
D. 比较X、Z非金属性强弱时,可比较其最高价氧化物对应的水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是

A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用等浓度的NaOH溶液分別滴定相同体积的NH4Cl、KH2PO4及CH3COOH溶液,滴定曲线如图所示,下列说法正确的是( )

A. NH3 ·H2O![]() NH4+ +OH- 的 lg Kb=-9.25
NH4+ +OH- 的 lg Kb=-9.25
B. CH3COOH+HPO42-=CH3 COO-+H2 PO4-的 lg K =2.11
C. 0.1mol/LKH2PO4溶液中:c(HPO42-)<c(H3PO4)
D. 在滴定过程中,当溶液pH相同时,消耗NaOH的物质的量:CH3COOH<KH2PO4<NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用13g锌粒与足量的稀硫酸反应制取氢气,同时得到100g密度为1.25g/mL的溶液,请计算(写出计算过程):(已知:Zn+H2SO4═ZnSO4+H2↑)
(1)生成氢气在标准状况下的体积为多少L_____?
(2)所得溶液中硫酸锌的物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量。常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如图所示,下列说法正确的是

A. 曲线I表示盐酸加水稀释过程中溶液电导率的变化
B. a、b、c三点溶液的pH:a>b>c
C. 将a、b两点溶液混合,所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
D. 氨水稀释过程中,c(NH4+)/ c(NH3·H2O)不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法正确的是
A. 煤经过气化、液化等一系列物理变化可转变为清洁燃料
B. 用植物秸秆造纸并将废水通过高压水井压到地下,可节约能源
C. 食品袋内活性炭粉、活性铁粉和![]() 组成的混合物作除氧剂和干燥剂
组成的混合物作除氧剂和干燥剂
D. 华为手机![]() 外壳上贴的碳纤维膜是一种新型有机高分子材料
外壳上贴的碳纤维膜是一种新型有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于非氧化还原反应的是( )
A. Fe2O3+3CO![]() 2Fe+3CO2 B. NH4NO3
2Fe+3CO2 B. NH4NO3![]() N2O↑+2H2O
N2O↑+2H2O
C. 2NaHCO3![]() Na2CO3+CO2↑+H2O D. CuO+CO═Cu+CO2
Na2CO3+CO2↑+H2O D. CuO+CO═Cu+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol/L的CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中一lgc(Cu2+)随滴入的Na2S溶液体积的变化如图所示(忽略滴加过程中的温度变化和溶液体积变化)。下列叙述正确的是

A. 常温下Ksp (CuS)的数量级为10-35
B. c点溶液中水的电离程度大于a点和d点溶液
C. b点溶液中c(Na+)=2c(Cl-)
D. d点溶液中c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com