
”¾ĢāÄæ”æČ”KClO3ŗĶMnO2µÄ»ģŗĻĪļ16.60g¼ÓČČÖĮŗćÖŲ£¬½«·“Ó¦ŗóµÄ¹ĢĢå¼Ó15gĖ®³ä·ÖČܽā£¬Ź£Óą¹ĢĢå6.55g (25”ę)£¬ŌŁ¼Ó5 gĖ®³ä·ÖČܽā£¬ČŌŹ£Óą¹ĢĢå4.80g(25”ę)”£
(1)ČōŹ£ÓąµÄ4.80g¹ĢĢåČ«ŹĒMnO2£¬ŌņŌ»ģŗĻĪļÖŠKClO3µÄÖŹĮæĪŖ________________g(±£Įō2Ī»Š”Źż)
(2)ČōŹ£ÓąµÄ4.80g¹ĢĢåŹĒMnO2ŗĶKClµÄ»ģŗĻĪļ£¬Ōņ25”ꏱKClµÄČܽā¶ČĪŖ_____£»Ō»ģŗĻĪļÖŠKClO3µÄÖŹĮæĪŖ________________g(±£Įō2Ī»Š”Źż)£»ĖłµĆKClČÜŅŗµÄĆܶČĪŖ1.72g/cm3£¬ŌņČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ______mol/L(±£Įō2Ī»Š”Źż)”£
(3)æÉÓĆŅŌĻĀ·“Ó¦ÖʱøKIO3ŗĶK2H3IO6(øßµāĖįĒā¶ž¼Ų)£ŗI2+2KClO3=2KIO3+Cl2¢Ł KIO3+Cl2+3KOH =K2H3IO6+2KCl ¢Ś×īÖÕÖʵƵÄKIO3ŗĶK2H3IO6µÄĪļÖŹµÄĮæÖ®±Čx£¬ČōÖʵĆ100molK2H3IO6, ¹²ĻūŗÄymolKClO3£¬ŹŌČ·¶ØyÓėxµÄ¹ŲĻµŹ½________________”£
”¾“š°ø”æ11.80 35g 12.25 5.99 y=100(1+x)
”¾½āĪö”æ
(1)ČōŹ£ÓąµÄ4.80g¹ĢĢåČ«ŹĒMnO2£¬m(KClO3)=×ÜÖŹĮæ- m(MnO2)
(2)ČōŹ£ÓąµÄ4.80g¹ĢĢåŹĒMnO2ŗĶKClµÄ»ģŗĻĪļ£¬Ōņ5gĖ®ČܽāĀČ»Æ¼ŲµĆµ½µÄČÜŅŗŹĒ±„ŗĶČÜŅŗ£¬¾Ż“Ė¼ĘĖćĘäČܽā¶Č£»·“Ó¦Ē°ŗóÖŹĮæ¼õÉŁµÄÖŹĮæĪŖŃõĘųµÄÖŹĮ棬øł¾ŻĀČĖį¼ŲŗĶŃõĘųÖ®¼äµÄ¹ŲĻµŹ½¼ĘĖćĀČĖį¼ŲµÄÖŹĮ棻øł¾ŻČÜŅŗÖŹĮ攢ĆÜ¶Č¼ĘĖćČÜŅŗĢå»ż£¬ŌŁ½įŗĻc=![]() ¼ĘĖćČÜŅŗµÄĪļÖŹµÄĮæÅØ¶Č£»
¼ĘĖćČÜŅŗµÄĪļÖŹµÄĮæÅØ¶Č£»
(3)ÓÉ·½³ĢŹ½æÉÖŖ£¬Õūøö¹ż³ĢKClO3ÖŠClŌ×ÓµÄĪļÖŹµÄĮæµČÓŚIŌ×ÓµÄĪļÖŹµÄĮ攣
(1)ČōŹ£ÓąµÄ4.80g¹ĢĢåČ«ŹĒMnO2£¬m(KClO3)=16.60g-4.80g=11.80g£»
(2)ČōŹ£ÓąµÄ4.80g¹ĢĢåŹĒMnO2ŗĶKClµÄ»ģŗĻĪļ£¬Ōņ5gĖ®ČܽāĀČ»Æ¼ŲµĆµ½µÄČÜŅŗŹĒ±„ŗĶČÜŅŗ£¬5gĖ®ČܽāKClµÄÖŹĮæ=6.55g-4.80g=1.75g£¬Ōņ100gĖ®ČܽāKClµÄÖŹĮæ=![]() ”Į100g=35g£¬¼“KClµÄČܽā¶ČĪŖ35g£»20gĖ®ČܽāĀČ»Æ¼ŲµÄÖŹĮæ=1.75g”Į4=7g£¬·“Ó¦Ē°ŗóÖŹĮæ¼õÉŁµÄÖŹĮæĪŖŃõĘųµÄÖŹĮ棬ŃõĘųµÄÖŹĮæ=16.60g-7g-4.80g=4.8g£¬øł¾ŻŃõŌ×ÓŹŲŗćµĆŌ»ģŗĻĪļÖŠKClO3µÄÖŹĮæĪŖ
”Į100g=35g£¬¼“KClµÄČܽā¶ČĪŖ35g£»20gĖ®ČܽāĀČ»Æ¼ŲµÄÖŹĮæ=1.75g”Į4=7g£¬·“Ó¦Ē°ŗóÖŹĮæ¼õÉŁµÄÖŹĮæĪŖŃõĘųµÄÖŹĮ棬ŃõĘųµÄÖŹĮæ=16.60g-7g-4.80g=4.8g£¬øł¾ŻŃõŌ×ÓŹŲŗćµĆŌ»ģŗĻĪļÖŠKClO3µÄÖŹĮæĪŖ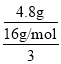 ”Į122.5g/mol=12.25g£¬ČÜŅŗµÄÖŹĮæ=20g+7g=27g£¬ČÜŅŗµÄĢå»ż=
”Į122.5g/mol=12.25g£¬ČÜŅŗµÄÖŹĮæ=20g+7g=27g£¬ČÜŅŗµÄĢå»ż=![]() £¬n(KCl)=
£¬n(KCl)=![]() £¬ŌņČÜŅŗµÄĪļÖŹµÄĮæÅضČ=
£¬ŌņČÜŅŗµÄĪļÖŹµÄĮæÅضČ=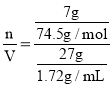 =5.99mol/L£»
=5.99mol/L£»
(3) ×īÖÕÖʵƵÄKIO3ŗĶK2H3IO6µÄĪļÖŹµÄĮæÖ®±Čx£¬ČōÖʵĆ100molK2H3IO6£¬Ōņ×īÖÕÖʵĆKIO3ĪŖ100xmol£¬ÓÉKIO3+Cl2+3KOH=K2H3IO6+2KClæÉÖŖ£¬ÖʵĆ100molK2H3IO6Ź±£¬ĻūŗÄKIO3100mol£¬ŌņÕūøö¹ż³ĢÖŠ×ܹ²ÖʱøKIO3ĪŖ100(1+x)mol£¬½įŗĻI2+2KClO3=2KIO3+Cl2æɵĆĻūŗÄ KClO3µÄĪļÖŹµÄĮæy=100(1+x)”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©A”¢B”¢CŹĒ֊ѧ»Æѧ³£¼ūµÄČżÖÖĪļÖŹ£¬ĖüĆĒÖ®¼äµÄĻą»„×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø²æ·Ö·“Ó¦Ģõ¼ž¼°²śĪļĀŌČ„£©

£Ø1£©ČōAŹĒŅ»ÖÖ»ĘÉ«µ„ÖŹ¹ĢĢ壬ŌņB”śCµÄ»Æѧ·½³ĢŹ½ĪŖ_______________”£ÅصÄDČÜŅŗŹ¹Ö½ÕűäŗŚĢåĻÖĮĖĖüµÄ___________ŠŌ”£
£Ø2£©ČōCŹĒŗģ×ŲÉ«ĘųĢ壬ŌņA»ÆѧŹ½æÉÄÜ_________£»Š“³öĻ”µÄDČÜŅŗÓėĶ·“Ó¦µÄĄėÓŚ·½³ĢŹ½___________________________________________”£
£ØII£©¹¤ŅµÉĻÖĪĮ¶ĀĮµÄŌĮĻŹĒĀĮĶĮ£ØÖ÷ŅŖ³É·ÖŹĒA12O3£¬ŌÓÖŹĪŖFe2O3”¢FeO”¢SiO2µČ£©”£Ä³ŃŠ¾æŠ”×čÉč¼ĘµÄĢį“æA12O3µÄ·½°øČēĻĀ

£Ø3£©ĀĖŅŗ2ÖŠŗ¬ÓŠµÄČÜÖŹÓŠNaOH”¢______ŗĶ______£ØĢī»ÆѧŹ½£©”£
£Ø4£©¼ÓČė¹żĮæNaOHČÜŅŗ¹żĀĖŗó£¬ČōĀĖŌüÖŠFe(OH)2±»æÕĘųŃõ»Æ£¬Š“³öĘä±»Ńõ»ÆµÄ»Æѧ·½³ĢŹ½___________________________”£
£Ø5£©Š“³öĶØČė¹żĮæCO2Éś³É³ĮµķAŹ±·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøßĆĢĖį¼ŲŹĒŅ»ÖÖµäŠĶµÄĒæŃõ»Æ¼Į£¬ČČ·Ö½ā²śÉśĆĢĖį¼Ų”¢¶žŃõ»ÆĆĢ”¢ŃõĘų”£Ķź³ÉĻĀĮŠĢīæÕ£ŗ
I. ŅŃÖŖ£ŗ¢ŁMnO2(s)=Mn(s)+O2(g) ¦¤H=+520kJ/mol
¢ŚS(s)+O2(g)=SO2(g) ¦¤H=-297kJ/mol
¢ŪMn(s)+2O2(g)+S(s)=MnSO4(s) ¦¤H=-1065kJ/mol
£Ø1£©¹ĢĢåMnO2ŗĶ¶žŃõ»ÆĮņĘųĢå·“Ó¦Éś³ÉMnSO4¹ĢĢåµÄČČ»Æѧ·½³ĢŹ½ĪŖ________________”£
II.²ŻĖįÄʵĪ¶Ø·Ø²ā¶ØøßĆĢĖį¼ŲµÄÖŹĮæ·ÖŹżÉę¼°µ½µÄ·“Ó¦£ŗ
C2O42-+2H+”śH2C2O4£Ø²ŻĖį£©
5H2C2O4+2MnO4-+6H+”ś2Mn2++10CO2”ü+8H2O
£Ø2£©ÉĻŹö·“Ó¦ŌŚ75”«80”ę½ųŠŠ±Č½ĻŗĻŹŹ£¬µ±¼ÓČČĪĀ¶Č“óÓŚ90”ꏱ£¬»įµ¼ÖĀ²ŻĖįÄĘĻūŗÄŌö¶ą£¬ĘäŌŅņŹĒ______________________”£
£Ø3£©½«Ņ»¶ØĮæøßĆĢĖį¼ŲČÜŅŗÓėĖį»ÆµÄ²ŻĖįÄĘČÜŅŗ»ģŗĻ£¬²āµĆ·“Ó¦ČÜŅŗÖŠMn2+µÄÅضČĖę·“Ó¦Ź±¼ätµÄ±ä»ÆČēĶ¼£¬Mn2+ÅØ¶Č±ä»ÆÓÉ»ŗĀżŌö“óŗóŃøĖŁŌö“óµÄŌŅņŹĒ____________________________”£

III .KMnO4ŹĒŅ»ÖÖ³£ÓĆĻū¶¾¼Į”£
£Ø4£©KMnO4Ļū¶¾»śĄķÓėĻĀĮŠĪļÖŹĻąĖʵďĒ__________£ØĢīŠņŗÅ£©”£
A. Ė«ŃõĖ® B.Ļū¶¾¾Ę¾«£Ø75%£© C.·ŹŌķĖ® D. 84Ļū¶¾Ņŗ£ØNaClOČÜŅŗ£©
£Ø5£©KMnO4Ļū¶¾Š§ĀŹ£ØÓƵ„Ī»ÖŹĮæ×ŖŅʵĵē×ÓŹż±ķŹ¾£©ŹĒNaClOµÄ______±¶£Ø±£ĮōĮ½Ī»Š”Źż£©”£
£Ø6£©²ā¶ØKMnO4²śĘ·µÄ“æ¶ČæÉÓƱź×¼Na2SO3ČÜŅŗµĪ¶Ø”£
¢ŁÅäÖĘ250ml0.1000mol/L±ź×¼Na2SO3ČÜŅŗ£¬ŠčŅŖŹ¹ÓĆµÄ²£Į§ŅĒĘ÷ÓŠÉÕ±”¢½ŗĶ·µĪ¹Ü”¢ĮæĶ²”¢²£Į§°ōŗĶ____________”£
¢ŚČ”ijKMnO4²śĘ·0.7000gČÜÓŚĖ®£¬²¢¼ÓČė____________½ųŠŠĖį»Æ”£
A. Ļ”ŃĪĖį B.Ļ”ĮņĖį C.ĻõĖį D. “ĪĀČĖį
¢Ū½«¢ŚĖłµĆČÜŅŗÓĆ0.1000mol/L±ź×¼Na2SO3ČÜŅŗ½ųŠŠµĪ¶Ø£¬µĪ¶ØÖĮÖÕµć¼ĒĀ¼ŹµŃéĻūŗÄNa2SO3ČÜŅŗµÄĢå»ż”£ÖŲø“²½Öč¢Ś”¢¢Ū£¬Čż“ĪĘ½ŠŠŹµŃ鏿¾ŻČē±ķ£ŗ
ŹµŃé“ĪŹż | 1 | 2 | 3 |
ĻūŗÄNa2SO3ČÜŅŗĢå»ż/ml | 19.30 | 20.98 | 21.02 |
£ØÓŠ¹ŲĄė×Ó·½³ĢŹ½ĪŖ£ŗ2MnO4- + 5SO32- + 6H+ £½5SO42- + 2Mn2+ + 3H2O£©
¼ĘĖćøĆKMnO4²śĘ·µÄ“æ¶ČĪŖ__________”££Ø±£ĮōČżĪ»ÓŠŠ§Źż×Ö£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
A. øßĪĀĻĀ£¬0.2 mol FeÓė×ćĮæĖ®ÕōĘų·“Ó¦£¬Éś³ÉµÄH2·Ö×ÓŹżÄæĪŖ0.3NA
B. ŹŅĪĀĻĀ£¬1 L pH=13µÄNaOHČÜŅŗÖŠ£¬ÓÉĖ®µēĄėµÄOH©Ąė×ÓŹżÄæĪŖ0.1NA
C. ĒāŃõČ¼ĮĻµē³ŲÕż¼«ĻūŗÄ22.4 L£Ø±ź×¼×“æö£©ĘųĢåŹ±£¬µēĀ·ÖŠĶعżµÄµē×ÓŹżÄæĪŖ2NA
D. 5NH4NO3![]() 2HNO3+4N2”ü+9H2O·“Ó¦ÖŠ£¬Éś³É28 g N2Ź±£¬×ŖŅʵĵē×ÓŹżÄæĪŖ3.75NA
2HNO3+4N2”ü+9H2O·“Ó¦ÖŠ£¬Éś³É28 g N2Ź±£¬×ŖŅʵĵē×ÓŹżÄæĪŖ3.75NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”涞¼×ĆŃŹĒŅ»ÖÖÖŲŅŖµÄĒå½ąČ¼ĮĻ”£ŗĻ³É¶ž¼×ĆŃŹĒ½ā¾öÄÜŌ“Ī£»śµÄŃŠ¾æ·½ĻņÖ®Ņ»”£
£Ø1£©ÓĆCO2ŗĶH2æÉŅŌŗĻ³É¶ž¼×ĆŃ(CH3OCH3)
ŅŃÖŖ£ŗCO(g)+2H2(g)=CH3OH(g) ”÷H1=-90.1kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) ”÷H2=-41.1kJ/mol
2 CH3OH(g) = CH3OCH3(g)+H2O(g) ”÷H3=-24.5kJ/mol
Ōņ·“Ó¦2CO2(g)+6H2(g)= CH3OCH3(g)+3H2O(g) ”÷H=________”£
£Ø2£©¶ž¼×ĆŃ(CH3OCH3)Č¼ĮĻµē³ŲæÉŅŌĢįÉżÄÜĮæĄūÓĆĀŹ”£ĄūÓƶž¼×ĆŃĖįŠŌ½éÖŹČ¼ĮĻµē³Ųµē½ā200mL±„ŗĶŹ³ŃĪĖ®(¶čŠŌµē¼«)£¬µē½āŅ»¶ĪŹ±¼äŗó£¬Ņõ¼«ŹÕ¼Æµ½±źæöĻĀµÄĒāĘų2.24L(Éčµē½āŗóČÜŅŗĢå»ż²»±ä)
¢Ł¶ž¼×ĆŃČ¼ĮĻµē³ŲµÄÕż¼«·“Ó¦Ź½ĪŖ_____________£¬øŗ¼«·“Ó¦Ź½ĪŖ___________”£
¢ŚĒėŠ“³öµē½āŹ³ŃĪĖ®µÄ»Æѧ·½³ĢŹ½_______________________”£
¢Ūµē½āŗóČÜŅŗµÄpH=_________£¬ĄķĀŪÉĻĻūŗĶž¼×ĆѵÄÖŹĮæĪŖ___________(±£ĮōŅ»Ī»Š”Źż)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŠšŹöÕżČ·µÄŹĒ( )
A.ŗ¬![]() øöĄė×ӵĹĢĢå
øöĄė×ӵĹĢĢå![]() ČÜÓŚĖ®Åä³É1LČÜŅŗ£¬ĖłµĆČÜŅŗÖŠ
ČÜÓŚĖ®Åä³É1LČÜŅŗ£¬ĖłµĆČÜŅŗÖŠ![]() µÄĪļÖŹµÄĮæÅضČĪŖ2
µÄĪļÖŹµÄĮæÅضČĪŖ2![]()
B.![]() ŌŚæÕĘųÖŠ³¤ĘŚ·ÅÖƱä»ė×ĒµÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ
ŌŚæÕĘųÖŠ³¤ĘŚ·ÅÖƱä»ė×ĒµÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ![]()
C.æÉŅŌÓĆ³ĪĒåŹÆ»ŅĖ®¼ų±š![]() ŗĶ
ŗĶ![]()
D.µĪ¼ÓKSCNĻŌŗģÉ«µÄČÜŅŗÖŠ“ęŌŚ£ŗ![]() ”¢
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©AgNO3µÄĖ®ČÜŅŗ³Ź________£ØĢī”°Ėį”±”¢”°ÖŠ”±”¢”°¼ī”±£©ŠŌ£¬ŹµŃéŹŅŌŚÅäÖĘAgNO3µÄČÜŅŗŹ±£¬³£½«AgNO3¹ĢĢåĻČČÜÓŚ½ĻÅصÄĻõĖįÖŠ£¬Č»ŗóŌŁÓĆÕōĮóĖ®Ļ”ŹĶµ½ĖłŠčµÄÅØ¶Č£¬ŅŌ____£ØĢī”°“Ł½ų”±”¢”°ŅÖÖĘ”±£©ĘäĖ®½ā”£
£Ø2£©ŅŃÖŖÄŃČܵē½āÖŹAµÄ»ÆѧŹ½ĪŖXnYm£¬Ļą¶Ō·Ö×ÓÖŹĮæĪŖM£¬²āµĆĘ䱄ŗĶČÜŅŗµÄĆܶČĪŖ¦Ń g/cm3£¬Xm£«µÄÅضČĪŖc mol/L£¬ŌņøĆÄŃČÜĪļXnYmµÄČܶȻż³£ŹżĪŖKsp£½________”£
£Ø3£©ĪļÖŹµÄĮæÅضČĻąĶ¬µÄ“×ĖįŗĶĒāŃõ»ÆÄĘČÜŅŗ»ģŗĻŗó£¬ČÜŅŗÖŠ“×ĖįøłĄė×ÓŗĶÄĘĄė×ÓÅضČĻąµČ£¬Ōņ»ģŗĻŗóČÜŅŗ³Ź_____£ØĢī”°Ėį”±”¢”°ÖŠ”±”¢”°¼ī”±£©ŠŌ£¬»ģŗĻŹ±“×ĖįĢå»ż________£ØĢī”°“óÓŚ”±”¢”°µČÓŚ”±»ņ”°Š”ÓŚ”±£©ĒāŃõ»ÆÄĘČÜŅŗĢå»ż”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮ½ÖÖŅ»ŌŖ¼īMOHŗĶROHµÄČÜŅŗ·Ö±š¼ÓĖ®Ļ”ŹĶ£¬ČÜŅŗpHµÄ±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ
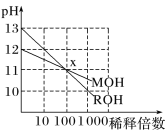
A. MOHŹĒŅ»ÖÖČõ¼ī
B. ŌŚxµć£¬c(M£«)£½c(R£«)
C. Ļ”ŹĶĒ°£¬c(ROH)£½10c(MOH)
D. Ļ”ŹĶĒ°MOHČÜŅŗŗĶROHČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc(OH£)Ē°ÕߏĒŗóÕßµÄ10±¶
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ĢÖÜĘŚÖ÷×åŌŖĖŲW”¢X”¢Y”¢ZµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬WŌŚ“óĘųÖŠÓŠĮ½ÖÖĶ¬ĖŲŅģŠĪĢåĒŅ¾łÄÜÖ§³ÖČ¼ÉÕ£¬XµÄŌ×Ó°ė¾¶ŹĒĖłÓŠ¶ĢÖÜĘŚÖ÷×åŌŖĖŲÖŠ×ī“óµÄ£¬·Ē½šŹōŌŖĖŲYµÄŌ×ÓŠņŹżŹĒZµÄ×īĶā²ćµē×ÓŹżµÄ2±¶”£ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ£Ø £©
A.Y”¢ZµÄĒā»ÆĪļĪČ¶ØŠŌY>Z
B.Yµ„ÖŹµÄČŪµćøßÓŚXµ„ÖŹ
C.X”¢W”¢ZÄÜŠĪ³É¾ßÓŠĒæŃõ»ÆŠŌµÄXZW
D. ÖŠWŗĶY¶¼Āś×ć8µē×ÓĪČ¶Ø½į¹¹
ÖŠWŗĶY¶¼Āś×ć8µē×ÓĪČ¶Ø½į¹¹
²éæ““š°øŗĶ½āĪö>>
¹ś¼ŹŃ§Š£ÓÅŃ” - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com