
【题目】高锰酸钾是一种典型的强氧化剂,热分解产生锰酸钾、二氧化锰、氧气。完成下列填空:
I. 已知:①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol
②S(s)+O2(g)=SO2(g) ΔH=-297kJ/mol
③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1065kJ/mol
(1)固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为________________。
II.草酸钠滴定法测定高锰酸钾的质量分数涉及到的反应:
C2O42-+2H+→H2C2O4(草酸)
5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O
(2)上述反应在75~80℃进行比较合适,当加热温度大于90℃时,会导致草酸钠消耗增多,其原因是______________________。
(3)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是____________________________。

III .KMnO4是一种常用消毒剂。
(4)KMnO4消毒机理与下列物质相似的是__________(填序号)。
A. 双氧水 B.消毒酒精(75%) C.肥皂水 D. 84消毒液(NaClO溶液)
(5)KMnO4消毒效率(用单位质量转移的电子数表示)是NaClO的______倍(保留两位小数)。
(6)测定KMnO4产品的纯度可用标准Na2SO3溶液滴定。
①配制250ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒、玻璃棒和____________。
②取某KMnO4产品0.7000g溶于水,并加入____________进行酸化。
A. 稀盐酸 B.稀硫酸 C.硝酸 D. 次氯酸
③将②所得溶液用0.1000mol/L标准Na2SO3溶液进行滴定,滴定至终点记录实验消耗Na2SO3溶液的体积。重复步骤②、③,三次平行实验数据如表:
实验次数 | 1 | 2 | 3 |
消耗Na2SO3溶液体积/ml | 19.30 | 20.98 | 21.02 |
(有关离子方程式为:2MnO4- + 5SO32- + 6H+ =5SO42- + 2Mn2+ + 3H2O)
计算该KMnO4产品的纯度为__________。(保留三位有效数字)
【答案】MnO2(s)+SO2(g)=MnSO4(s) H= -248kJ· mol -1 部分草酸发生分解,会导致草酸钠消耗偏多 生成的Mn2+可能对该反应有催化作用,随着Mn2+的产生,反应速率大大加快 A D 1.18 250mL容量瓶 B 18.7%
【解析】
I. (1)①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol;②S(s)+O2(g)=SO2(g) ΔH=-297kJ/mol;③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1065kJ/mol;将①+③-②可得;
(2)草酸钠不稳定,当加热温度大于90℃时,部分草酸发生分解,会导致草酸钠消耗偏多;
(3)Mn2+对反应有催化作用;
(4)KMnO4是强氧化剂,与其相似的是双氧水和84消毒液;
(5)假设相同质量的KMnO4和NaClO都为100g,根据得失电子数量计算;
(6) ①配制250mL0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒、玻璃棒和250mL容量瓶;
②盐酸和高锰酸钾反应生成氯气,硝酸和次氯酸具有氧化性会干扰高锰酸钾的氧化反应;
③从数据的比较中可以看出,第1组数据为失真数据,后两组数据的平均值为![]() =21mL,根据相关公式可以计算。
=21mL,根据相关公式可以计算。
I. (1)①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol;②S(s)+O2(g)=SO2(g) ΔH=-297kJ/mol;③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1065kJ/mol;将①+③-②得,固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为:MnO2(s)+SO2(g)=MnSO4(s) H= -248kJ· mol -1;
(2)草酸钠不稳定,当加热温度大于90℃时,部分草酸发生分解,会导致草酸钠消耗偏多;
(3)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是随着c(Mn2+)的不断增大,反应速率大大加快,生成的Mn2+对反应有催化作用,且c(Mn2+)越大,催化效果越好;
(4)KMnO4是强氧化剂,与其相似的是双氧水和84消毒液,故选AD;
(5)假设相同质量的KMnO4和NaClO都为100g,KMnO4做氧化剂生成Mn2+,转移电子![]() =3.16mol;NaClO做氧化剂生产Cl-,转移电子
=3.16mol;NaClO做氧化剂生产Cl-,转移电子![]() =2.68;
=2.68;![]() =1.18,则KMnO4消毒效率(用单位质量转移的电子数表示)是NaClO的1.18倍;
=1.18,则KMnO4消毒效率(用单位质量转移的电子数表示)是NaClO的1.18倍;
(6) ①配制250mL0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒、玻璃棒和250mL容量瓶,故答案为:250mL容量瓶;
②盐酸和高锰酸钾反应生成氯气,故不能用盐酸酸化高锰酸钾;硝酸和次氯酸具有氧化性会干扰高锰酸钾的氧化反应,不选;所以需要用稀硫酸酸化高锰酸钾,选B;
③从数据的比较中可以看出,第1组数据为失真数据,后两组数据的平均值为![]() =21mL,测定过程中发生反应的离子方程式为:2MnO4- + 5SO32- + 6H+ =5SO42- + 2Mn2+ + 3H2O,则n(MnO4-)=
=21mL,测定过程中发生反应的离子方程式为:2MnO4- + 5SO32- + 6H+ =5SO42- + 2Mn2+ + 3H2O,则n(MnO4-)=![]() n(SO32-)=
n(SO32-)=![]() =0.00084mol,该KMnO4产品的纯度为
=0.00084mol,该KMnO4产品的纯度为![]() =18.7%。
=18.7%。


科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关.下列说法不正确的是![]()
A.医学上,血液透析是利用了胶体的渗析原理
B.碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂
C.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
D.铜的金属性比铝弱,可以用铜罐贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是

A. 腐蚀过程中铜极上始终只发生: 2H++2e-= H2↑
B. 若水膜中溶有食盐将加快铁铆钉的腐蚀
C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀
D. 若将该铜板与直流负极相连,则铁铜均难被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、Al2Cl7-和有机阳离子组成电解质溶液,其放电工作原理如图所示。下列说法正确的是
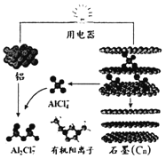
A.放电时电子由石墨电极经用电器流向铝电极
B.充电时铝电极上发生氧化反应
C.充电时,AlCl4-向铝电极方向移动
D.放电时,负极反应为Al-3e-+7AlCl4-═4Al2Cl7-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时下列物质的溶度积
CH3COOAg | AgCl | AgCrO4 | AgS | |
Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是( )
A.等体积浓度均为0.02molL-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.浓度均为0.01molL-1的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀
C.在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式:CH3COOAg+H++C1-=CH3COOH+AgCl
D.298K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型药物H(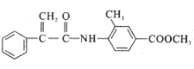 )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:

已知:①E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色
②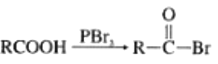 (R为烃基)
(R为烃基)
③ +HBr
+HBr
请回答下列问题:
(1)A的结构简式为______________;E的官能团的名称为_____________。
(2)①的化学反应类型是______________;④的反应类型是______________。
(3)写出C→D的化学方程式__________________________________________。
(4)写出F+G→H的化学方程式__________________________________________。
(5)E有多种同分异构体,同时满足下列条件的E的同分异构体有_________种。
ⅰ.能发生银镜反应 ⅱ. 能发生水解反应 ⅲ. 分子中含的环只有苯环
(6)参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,可逆反应C(s)+CO2(g)![]() 2CO(g),达到平衡状态的标志是( )
2CO(g),达到平衡状态的标志是( )
①单位时间内生成n molCO2的同时生成n molC ②单位时间内生成n molCO2 的同时生成2n mol CO ③CO2 、CO的物质的量浓度之比为1: 2的状态 ④混合气体的密度不再改变的状态 ⑤混合气体的压强不再改变的状态 ⑥C的质量不再改变的状态
A. ①④⑤⑥ B. ②④⑤⑥ C. ②③⑤⑥ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5 g水充分溶解,仍剩余固体4.80g(25℃)。
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为________________g(保留2位小数)
(2)若剩余的4.80g固体是MnO2和KCl的混合物,则25℃时KCl的溶解度为_____;原混合物中KClO3的质量为________________g(保留2位小数);所得KCl溶液的密度为1.72g/cm3,则溶液的物质的量浓度为______mol/L(保留2位小数)。
(3)可用以下反应制备KIO3和K2H3IO6(高碘酸氢二钾):I2+2KClO3=2KIO3+Cl2① KIO3+Cl2+3KOH =K2H3IO6+2KCl ②最终制得的KIO3和K2H3IO6的物质的量之比x,若制得100molK2H3IO6, 共消耗ymolKClO3,试确定y与x的关系式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 2NaOH(s)+H2SO4(aq)→Na2SO4(aq)+2H2O(l)+Q kJ 说法正确的是( )
A.NaOH(s)溶于水的过程中扩散吸收的能量大于水合释放的能量
B.Q<0
C.NaOH(s)+1/2H2SO4(aq)→1/2Na2SO4(aq)+H2O(l)+1/2QkJ
D.若将上述反应中的NaOH(s)换成NaOH(aq),则Q′>Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com