
【题目】室温下,向10mL0.1mol·Lˉ1NaOH溶液中加入0.1mol·Lˉ1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A.a点所示溶液中c(Na+)>c(Aˉ)>c(H+)>c(HA)
B.pH=7时,加入HA的体积<10mL
C.pH=7时,c(Na+)=c(Aˉ)+c(HA)
D.b点所示溶液中c(Aˉ)>c(HA)
【答案】D
【解析】
室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,a点酸碱的物质的量相等,二者恰好反应生成NaA,但溶液呈碱性,说明生成的盐是强碱弱酸盐,则HA是弱酸;要使混合溶液呈中性,则HA应该稍微过量,所以b点HA体积大于10mL。
A. a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性,水解生成的HA的浓度大于水电离的氢离子浓度,所以c(HA)>c(H+),A错误;
B. a点为NaA溶液,要使碱性溶液呈中性,应加入HA溶液得到NaA和HA的混合液,则pH=7时,加入HA的体积>10mL,B错误;
C. pH=7时,得到NaA和HA的混合液,溶液中存在电荷守恒关系,c(Na+)+ c(H+)=c(Aˉ)+c(OH-),由c(H+)=c(OH-)可得c(Na+)=c(Aˉ),C错误;
D. b点为等浓度的NaA和HA的混合液,由图可知溶液呈酸性,说明HA电离程度大于A-水解程度,则溶液中c(A-)>c(HA),D正确。
故选D。


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断正确的是

A. 三种酸对应电离常数Ka的大小关系为:HD<HB<HA
B. 滴定至P点时,溶液中:c(Na+)+ c(H+) = c(OH-)+ c(HB)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,三种溶液中:c(A-)<c(B-)<c(D-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )。
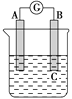
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用反应4HCl(浓)+MnO2![]() MnCl2+2H2O+Cl2↑。制取纯净、干燥的氯气,装置如图所示:
MnCl2+2H2O+Cl2↑。制取纯净、干燥的氯气,装置如图所示:

请回答下列问题:
(1)a装置的名称________
(2)收集氯气的方法有________
(3)烧瓶中发生反应的离子方程式为___________
(4)装置B中饱和食盐水的作用是_______,装置E的作用是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.锌粒与稀醋酸反应:Zn+2H+=Zn2++H2↑
B.铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+
C.实验室制备氯气的反应:MnO2+2Clˉ+4H+![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.硫酸氢铵溶液和少量氢氧化钠溶液反应:OHˉ+NH4+=NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是
A. 该酸式盐的水溶液一定显酸性
B. 在该盐溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 若HY-能水解,水解方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
D. 若HY-能电离,电离方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 25℃时 NH4Cl 溶液的 KW 大于 100℃时 NaCl 溶液的 KW
B. 常温下,pH 均为 5 的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度之比为 1:104
C. 根据溶液的 pH 与酸碱性的关系,推出 pH=6.8 的溶液一定显酸性
D. 100℃时,将 pH=2 的盐酸与 pH=12 的 NaOH 溶液等体积混合,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在 100℃时,pH=6,该温度下 0.1molL﹣1 的 NaOH 溶液中,溶液的 pH=_____。
(2)25℃时,向水中加入少量碳酸钠固体,得到 pH 为 11 的溶液,其水解的离子方程式为_____, 由水电离出的 c(OH﹣)=_____molL﹣1。
(3)体积均为 100mL、pH 均为 2 的盐酸与一元酸 HX,加水稀释过程中 pH 与溶液体积的关系如图所示,则 HX 是_____(填“强酸”或“弱酸”),理由是_____。

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。
化学式 | 电离常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,等浓度的 NaCN 溶液、Na2CO3 溶液和 CH3COONa 溶液,pH 由大到小的顺序为________(填化学式)。
②25℃时,在 0.5mol/L 的醋酸溶液中由醋酸电离出的 c(H+)约是由水电离出的 c(H+)的_________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关![]() 和
和![]() 混合溶液的叙述正确的是( )
混合溶液的叙述正确的是( )
A. 向该溶液中加入浓盐酸,每产生![]() ,转移电子约为
,转移电子约为![]() 个
个
B. 该溶液中,![]() 可以大量共存
可以大量共存
C. 滴入少量![]() 溶液,反应的离子方程式为:
溶液,反应的离子方程式为:![]()
D. 为验证![]() 的水解,用
的水解,用![]() 试纸测该溶液的
试纸测该溶液的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com