
【题目】2019 年诺贝尔化学奖用于奖励对锂离子电池的发展做出贡献的三位科学家。锂离子电池如今被用于各个领域,使一个无化石燃料的社会成为可能。LiFePO4是新型锂离子电池的正极材料。某小组拟设计以一种锂辉石(主要成分为Li2O Al2O34SiO2,含少量铁、钙、镁)为原料制备纯净的碳酸锂,进而制备LiFePO4的工艺流程:
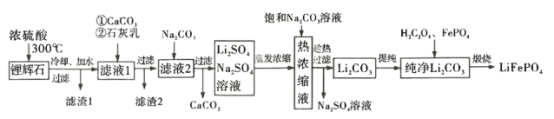
已知:Li2OAl2O34SiO2+H2SO4(浓)![]() Li2SO4+Al2O34SiO2H2O↓回答下列问题:
Li2SO4+Al2O34SiO2H2O↓回答下列问题:
(1)LiFePO4 中铁元素的化合价为_____,铁元素进行焰色反应的颜色是_______(填序号)。
A.无焰色反应 B.黄色 C.紫色 D.砖红色
(2)向滤液 1 中加入适量的 CaCO3 细粉用于消耗硫酸并将 Fe3+转化为红褐色沉淀,若![]() =3,反应的化学方程式为___;滤渣2 的主要成分是 Fe(OH)3、___(填化学式)
=3,反应的化学方程式为___;滤渣2 的主要成分是 Fe(OH)3、___(填化学式)
(3)已知碳酸锂在水中的溶解度随温度升高而减小,上述流程中趁热过滤的目的是__。
(4)流程中加H2C2O4和FePO4,用于煅烧制备 LiFePO4,该反应的化学方程式为____。
(5)若滤液1中c(Mg2+)=0.2 mol/L,向其中加入双氧水和磷酸(设溶液体积增加 1 倍),使Fe3+恰好沉淀完全即溶液中 c(Fe3+)=1.0×10-5 mol/L,此时是否有 Mg3 (PO4)2 沉淀生成?_____(列式计算说明)。已知 FePO4 、Mg3 (PO4)2 的 Ksp 分别为 1.3×10-22、1.0×10-24。(6)一种锂离子电池的反应原理为 LiFePO4![]() Li+FePO4。写出放电时正极电极反应式: ____。
Li+FePO4。写出放电时正极电极反应式: ____。
【答案】+2 A Fe2(SO4)3+3H2SO4+6CaCO3= 2Fe(OH)3+6CaSO4+6CO2↑ Mg(OH)2 CaSO4 减小 Li2CO3 的溶解损失 Li2CO3+H2C2O4+2FePO4 ![]() 2LiFePO4+3CO2↑+H2O↑ 由 Ksp(FePO4)可知 c(PO
2LiFePO4+3CO2↑+H2O↑ 由 Ksp(FePO4)可知 c(PO![]() )=
)= ![]() =1.3×10-17mol·L-1;Qc[Mg3(PO4)2]= c3(Mg2+)· c2(PO
=1.3×10-17mol·L-1;Qc[Mg3(PO4)2]= c3(Mg2+)· c2(PO![]() )=
)=![]() ×(1.3×10-17mol·L-1)2=1.69×10-37<Ksp,因此不会生成 Mg3(PO4)2 沉淀 FePO4+ Li ++e-=LiFePO4
×(1.3×10-17mol·L-1)2=1.69×10-37<Ksp,因此不会生成 Mg3(PO4)2 沉淀 FePO4+ Li ++e-=LiFePO4
【解析】
锂辉石(主要成分为Li2O·Al2O3·4SiO2,含少量铁、钙、镁)加入浓硫酸共热,根据已知信息可知得到的滤渣1主要成分为Al2O3·4SiO2·H2O,滤液中的主要阳离子有Fe3+、Mg2+、Ca2+、Li+;加入碳酸钙和石灰乳可以将过量的氢离子和Fe3+、Mg2+除去,滤渣2主要为Fe(OH)3、Mg(OH)2以及硫酸钙;滤液主要杂质离子有Ca2+和SO42-;再加入碳酸钠将钙离子除去,得到硫酸锂和硫酸钠的混合溶液,蒸发浓缩后加入饱和碳酸钠溶液,趁热过滤得到碳酸锂沉淀;提纯后加入草酸和磷酸铁经煅烧得到LiFePO4。
(1)由化合价代数和等于0得:LiFePO4 中铁元素的化合价为+2价,铁元素进行焰色反应的颜色是无焰色反应,故答案为:+2;A;
(2)向滤液 1 中加入适量的 CaCO3 细粉用于消耗硫酸并将 Fe3+转化为红褐色沉淀,若![]() =3,溶液中有过量的硫酸,所以方程式为Fe2(SO4)3+3H2SO4+6CaCO3= 2Fe(OH)3+6CaSO4+6CO2↑;根据分析可知滤渣2的主要成分是Fe(OH)3、Mg(OH)2以及CaSO4;故答案为:Fe2(SO4)3+3H2SO4+6CaCO3= 2Fe(OH)3+6CaSO4+6CO2↑;Mg(OH)2以及CaSO4;
=3,溶液中有过量的硫酸,所以方程式为Fe2(SO4)3+3H2SO4+6CaCO3= 2Fe(OH)3+6CaSO4+6CO2↑;根据分析可知滤渣2的主要成分是Fe(OH)3、Mg(OH)2以及CaSO4;故答案为:Fe2(SO4)3+3H2SO4+6CaCO3= 2Fe(OH)3+6CaSO4+6CO2↑;Mg(OH)2以及CaSO4;
(3)已知碳酸锂在水中的溶解度随温度升高而减小,上述流程中趁热过滤的目的是减小碳酸锂的溶解度,减少碳酸锂的溶解损耗;故答案为:减少碳酸锂的溶解损耗;
(4)流程中加H2C2O4和FePO4,煅烧制备过程的原料为Li2CO3、H2C2O4和FePO4,产物中有LiFePO4,铁元素的化合价降低,则该过程中某种物质被氧化,根据元素化合价变化规律可知草酸中的C元素被氧化,由+3价升高为+4价,结合电子守恒和元素守恒可知方程式为:Li2CO3+H2C2O4+2FePO4![]() 2LiFePO4+3CO2↑+H2O↑。故答案为:Li2CO3+H2C2O4+2FePO4
2LiFePO4+3CO2↑+H2O↑。故答案为:Li2CO3+H2C2O4+2FePO4 ![]() 2LiFePO4+3CO2↑+H2O↑;
2LiFePO4+3CO2↑+H2O↑;
(5)若滤液1中c(Mg2+)=0.2 mol·L-1,向其中加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中 c(Fe3+)=1.0×10-5mol·L-1,由 Ksp(FePO4)可知 c(PO![]() )=
)= ![]() =1.3×10-17mol·L-1;Qc[Mg3(PO4)2]= c3(Mg2+)· c2(PO
=1.3×10-17mol·L-1;Qc[Mg3(PO4)2]= c3(Mg2+)· c2(PO![]() )=
)=![]() ×(1.3×10-17mol·L-1)2=1.69×10-37<Ksp,因此不会生成 Mg3(PO4)2 沉淀。故答案为:由 Ksp(FePO4)可知 c(PO
×(1.3×10-17mol·L-1)2=1.69×10-37<Ksp,因此不会生成 Mg3(PO4)2 沉淀。故答案为:由 Ksp(FePO4)可知 c(PO![]() )=
)= ![]() =1.3×10-17mol·L-1;Qc[Mg3(PO4)2]= c3(Mg2+)· c2(PO
=1.3×10-17mol·L-1;Qc[Mg3(PO4)2]= c3(Mg2+)· c2(PO![]() )=
)=![]() ×(1.3×10-17mol·L-1)2=1.69×10-37<Ksp,因此不会生成 Mg3(PO4)2 沉淀;
×(1.3×10-17mol·L-1)2=1.69×10-37<Ksp,因此不会生成 Mg3(PO4)2 沉淀;
(6)一种锂离子电池的反应原理为LiFePO4![]() Li+FePO4,放电时正极铁元素得电子,发生还原反应,电极反应式: FePO4+ Li ++e-=LiFePO4。故答案为:FePO4+Li ++e-=LiFePO4。
Li+FePO4,放电时正极铁元素得电子,发生还原反应,电极反应式: FePO4+ Li ++e-=LiFePO4。故答案为:FePO4+Li ++e-=LiFePO4。


科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数值。下图表示 N2O 在Pt2O+表面与 CO 反应转化成无害气体的过程。下列说法正确的是
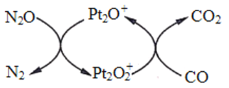
A.N2O 转化成无害气体时的催化剂是![]() B.1g N2O 气体中含有电子数为 0.5NA
B.1g N2O 气体中含有电子数为 0.5NA
C.1mol CO2 中含有 2NA 个共用电子对D.1mol Pt2O+转化为 ![]() 得电子数为 3NA
得电子数为 3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 原子序数依次增大,X均能与其他三种元素形成共价化合物。四种元素组成某正盐M的水溶液遇到三价铁离子时,呈现血红色。下列说法错误的是( )
原子序数依次增大,X均能与其他三种元素形成共价化合物。四种元素组成某正盐M的水溶液遇到三价铁离子时,呈现血红色。下列说法错误的是( )
A.M遇到浓氢氧化钠溶液时,会产生使蓝色石蕊试纸变红的气体
B.Y的某种氢化物可做植物生长调和剂,催熟水果
C.Z的氧化物对应水化物可能是弱酸
D.化合物(WYZ)2中所有原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有一类组成最简单的有机硅化合物叫硅烷,硅烷的组成、结构与相应的烷烃相似。
(1)写出硅烷的通式:____________。
(2)写出乙硅烷在空气中自燃的化学方程式:___________。
(3)甲硅烷的密度________(填“大于”、“小于”或“等于”)甲烷。
(4)甲硅烷的热稳定性________(填“大于”、“小于”或“等于”)甲烷。
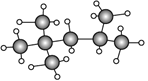
II.(1)某烃A的球棍模型如图所示,其分子式为:______,A的一氯代物有________种;B与A互为同系物,相对分子质量为58,请写出B的所有同分异构体的结构简式__________________。
(2)含有![]() 的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。广泛用作农用薄膜的聚氯乙烯塑料,是由CH2=CH—Cl聚合而成的,其化学反应方程式为______________________________________。
的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。广泛用作农用薄膜的聚氯乙烯塑料,是由CH2=CH—Cl聚合而成的,其化学反应方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
A. v(N2)=0.25 mol·L-1·min-1
B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=1 mol·L-1·min-1
D. v(NH3)=0.5 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为
A.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B.ΔH4=
(ΔH1+ΔH2-3ΔH3)B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D.ΔH4=
(ΔH1+ΔH2-3ΔH3)D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
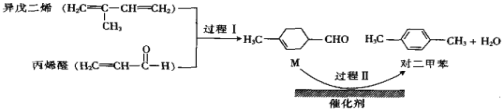
下列说法不正确的是( )
A.M的某种同分异构体含有苯环且能与钠反应放出氢气
B.可用溴水鉴别M和对二甲苯
C.对二甲苯的一氯代物有2种
D.异戊二烯所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HCOOH和CH3COOH的电离常数分别1.80×104和1.75×105。将pH=3,体积均为V0的两种酸溶液分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述错误的是( )
的变化如图所示。下列叙述错误的是( )
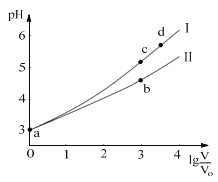
A.溶液中水的电离程度:b点<c点
B.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.从c点到d点,溶液中![]() 不变(HA、A-分别代表相应的酸和酸根离子)
不变(HA、A-分别代表相应的酸和酸根离子)
D.若两溶液无限稀释,则它们的c(H+)相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com