
【题目】为了配制NH4+与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
①适量的HC1 ②适量的NH4NO3 ③适量的氨水 ④适量的NaOH
A. ①② B. ②③ C. ③④ D. ①②③④
【答案】B
【解析】
根据外因对水解平衡的影响分析,注意特殊条件下电荷守恒原理的应用。
NH4Cl溶液中有水解平衡NH4++H2O![]() NH3·H2O+H+, 使c(NH4+) < c(Cl-)。①加入HC1后有电荷守恒c(NH4+) +c(H+)=c(Cl-)+c(OH-),因NH4Cl与HC1的混合溶液一定酸性:c(H+)>c(OH-),仍有c(NH4+) < c(Cl-)。②加入适量的NH4NO3,c(NH4+)增大,可使c(NH4+) = c(Cl-)。③加入适量的氨水时,电荷守恒c(NH4+) +c(H+)=c(Cl-)+c(OH-),当混合溶液呈中性时有c(NH4+) = c(Cl-)。④加入适量的NaOH后,与NH4Cl反应消耗NH4+,始终有c(NH4+) < c(Cl-)。
NH3·H2O+H+, 使c(NH4+) < c(Cl-)。①加入HC1后有电荷守恒c(NH4+) +c(H+)=c(Cl-)+c(OH-),因NH4Cl与HC1的混合溶液一定酸性:c(H+)>c(OH-),仍有c(NH4+) < c(Cl-)。②加入适量的NH4NO3,c(NH4+)增大,可使c(NH4+) = c(Cl-)。③加入适量的氨水时,电荷守恒c(NH4+) +c(H+)=c(Cl-)+c(OH-),当混合溶液呈中性时有c(NH4+) = c(Cl-)。④加入适量的NaOH后,与NH4Cl反应消耗NH4+,始终有c(NH4+) < c(Cl-)。
本题选B。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氢气和水,反应方程式可表示为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(1)一定条件下,在容积为2L的容器内进行该反应,20min时达到平衡,生成N2 0.4mol,则平均反应速率v(NO)=___________________。可从混合气体的颜色变化判断上述反应是否达到平衡,其理由是_______________________________________________。
(2)工业上也用氨水吸收SO2尾气,最终得到(NH4)2SO4,(NH4)2SO4溶液中c(NH4+)与c(SO42-)之比____2:1(选填“>”、“<”、“=”),用离子方程式解释其原因______________________。
(3)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚铝酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2+HCl→ClO2↑+NaCl+_____(没有配平)
(4)补全方程式并配平,标出电子转移方向和数目_________________________ 。
(5)该反应中氧化剂和还原剂的物质的量之比是___________。若生成0.2molClO2,转移电子数为_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因是:____________________________________________。
(2)在恒温条件下,1 mol NO2和足量C发生反应2NO2(g)+2C(s)![]() N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A) ___________Kc(B)(填“<”或“>”或“=”)
②A、B、C三点中NO2的转化率最高的是___________(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp=___________MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)已知:亚硝酸(HNO2)性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11。在常温下向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小的顺序是______________________。
(4)已知:常温下甲胺(CH3NH2)的电离常数为Kb,且pKb=-lgKb=3.4水溶液中有CH3NH2+H2OCH3NH3++OH-。常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,则溶液pH=_______。
(5)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ· mol-1
②CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) △H=-189.2 kJ· mol-1
反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) △H=___________ kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A. FeCl3溶液滴入Mg(OH)2浊液中,白色浑浊转化为红褐色沉淀
B. AgNO3溶液滴入氯水中,产生白色沉淀,随后淡黄绿色褪去
C. Na块放在坩埚里并加热,发出黄色火焰,生成淡黄色固体
D. H2C2O4溶液滴入KMnO4酸性溶液中,产生气泡,随后紫色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年是“国际化学元素周期表年”。 1869 年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法中错误的是
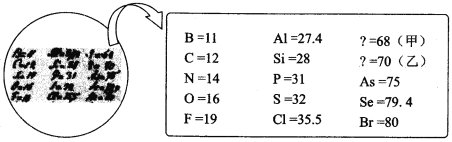
A. 甲位于现行元素周期表第四周期第ⅢA 族B. 原子半径比较:甲>乙> Si
C. 乙的简单气态氢化物的稳定性强于CH4D. 推测乙的单质可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用等物质的量的反应物在恒容容器中模拟工业生产SO3,得到三组实验数据如下表所示:
实验 序号 | 温度 (℃) | SO2浓度(mo1/L) | ||||||
0min | 10min | 20min | 30min | 40min | 50min | 60min | ||
1 | 300 | 2.00 | 1.70 | 1.50 | 1.36 | 1.25 | 1.20 | 1.20 |
2 | 300 | 2.00 | 1.50 | 1.28 | 1.20 | 1.20 | 1.20 | 1.20 |
3 | 500 | 2.00 | 1.60 | 1.39 | 1.29 | 1.27 | 1.27 | 1.27 |
(1)实验1中,50~60mn时间段,SO2浓度均为1.20mo1/L的原因是___。
(2)实验2中,前20min内以O2的浓度变化表示的化学反应速率为___。
(3)三组实验中,只有1、2中的某组使用了催化剂,则使用催化剂的为第___组,分析实验1、2中的数据,你认为催化剂___(填“能”或“不能”)改变SO2的平衡转化率,理由是___。
(4)分析表格中的数据,温度升高,SO2的平衡转化率会___(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出M原子核外能量最高的电子的电子排布式:___________。
②常温下,不能与R单质发生反应的是_______(选填序号)。
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2![]() Si3N4+CO
Si3N4+CO
①Si3N4中氮元素的化合价为-3,请解释Si3N4中氮元素化合价为负价的原因__________________。
②C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:______________________。
③配平上述反应的化学方程式,并标出电子转移的数目和方向。_______________。
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:

①将工业硅粉碎的目的是______________________________。
②适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。![]() 可能是______(选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________。
可能是______(选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗结肠炎药物Y结构如图所示,以下说法错误的是

A. 该有机物既能和酸反应又能和碱反应
B. 1mol该有机物可以和2molNaOH发生反应
C. 该有机物可以发生缩聚反应
D. 该有机物不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com