
����Ŀ��������Ļ������ڹ�ũҵ�����������о�����ҪӦ�á���ش��������⣺
(1)���������г���N2H4��Ϊ����������ȼ����N2H4�백�����ƣ���һ�ּ������壬������ˮ����������N2H4��H2O���õ��뷽��ʽ��ʾN2H4��H2O�Լ��Ե�ԭ���ǣ�____________________________________________��
(2)�ں��������£�1 mol NO2������C������Ӧ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��

��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A) ___________Kc(B)(�<����>����=��)
��A��B��C������NO2��ת������ߵ���___________(�A����B����C��)�㡣
������C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp=___________MPa(Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
(3)��֪��������(HNO2)���ʺ��������ƣ�������һ�����ᡣ������������ĵ���ƽ�ⳣ��Ka=5.1��10��4��H2CO3��Ka1=4.2��10��7��Ka2=5.61��10��11���ڳ���������2mol̼���Ƶ���Һ�м���1mol��HNO2������Һ��CO32����HCO3����NO2��������Ũ���ɴ�С��˳����______________________��
(4)��֪�������¼װ�(CH3NH2)�ĵ��볣��ΪKb����pKb=��lgKb=3.4ˮ��Һ����CH3NH2+H2OCH3NH3++OH������������CH3NH2��Һ�μ�ϡ������c(CH3NH2)=c(CH3NH3+)ʱ������ҺpH=_______��
(5)һ��ú̿������������Ԫ����CaSO4���γɹ̶���������������CO�ֻ���CaSO4������ѧ��Ӧ����ص��Ȼ�ѧ����ʽ���£�
��CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ��H=+210.5kJ�� mol��1
��CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) ��H=��189.2 kJ�� mol��1
��ӦCaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) ��H=___________ kJ�� mol��1
���𰸡�N2H4��H2O![]() N2H5++OH-����N2H4+H2O
N2H5++OH-����N2H4+H2O![]() N2H5++OH-�� = A 2 c(HCO3��)>c(NO2��)>c(CO32��) 10.6 -399.7
N2H5++OH-�� = A 2 c(HCO3��)>c(NO2��)>c(CO32��) 10.6 -399.7
��������
(1) N2H4���H2O�����������ʹ��Һ�ʼ��ԣ�
(2)��ƽ�ⳣ��ֻ���¶�Ӱ�죬�ݴ��жϣ�
������ѹǿƽ�������������С�ķ����ƶ���
����C��ʱ��������̼�����������Ũ����ȣ����ݷ�Ӧ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬�ݴ�ȷ�����ɷ�������������������ȷ����Ӧ��ѹǿƽ�ⳣ��Kp��
N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬�ݴ�ȷ�����ɷ�������������������ȷ����Ӧ��ѹǿƽ�ⳣ��Kp��
(3)������볣��Խ������Խǿ�����������ˮ��̶�ԽС��
(4) ����Kb=![]() =c(OH-)���㣻
=c(OH-)���㣻
(5) ���ø�˹���ɽ���-�ٿɵ�CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)��Ӧ�ȡ�
(1)��������ˮ�������백���Ƶ�������������OH-�������ӣ����뷽��ʽΪN2H4��H2O![]() N2H5++OH-��
N2H5++OH-��
��ˣ�������ȷ���ǣ�N2H4��H2O![]() N2H5++OH-��
N2H5++OH-��
(2)��ƽ�ⳣ��ֻ���¶�Ӱ�죬����Kc(A) =Kc(B)��
��ˣ�������ȷ���ǣ�=��
������ѹǿƽ�������������С�ķ����ƶ����÷�Ӧ������Ӧ�������������ķ�Ӧ������A��B��C������NO2��ת������ߵ���A�㣬
��ˣ�������ȷ���ǣ�A��
����C��ʱ��������̼�����������Ũ����ȣ����ݷ�Ӧ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬���Ի��������CO2���������Ϊ
N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬���Ի��������CO2���������Ϊ![]() ��NO2���������
��NO2���������![]() ��N2���������
��N2���������![]() �����Է�Ӧ��ѹǿƽ�ⳣ��Kp=
�����Է�Ӧ��ѹǿƽ�ⳣ��Kp=![]() =
=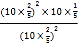 =2MPa��
=2MPa��
��ˣ�������ȷ���ǣ�2��
(3)2mol̼���Ƶ���Һ�м���1mol��HNO2�õ�����1mol̼���ơ�1mol̼�����ƺ�1mol�������ƵĻ��Һ����������ĵ���ƽ�ⳣ��Ka=5.1��10��4��H2CO3��Ka1=4.2��10��7��Ka2=5.61��10��11�����ж�ˮ��̶ȴ�С˳��ΪCO32��> NO2����CO32-ˮ������HCO3����ˮ��ij̶Ƚ�С��������Һ��CO32�����ӡ�HCO3�����Ӻ�NO2�����ӵ�Ũ�ȴ�С��ϵΪc(HCO3��)>c(NO2��)>c(CO32��)��
��ˣ�������ȷ���ǣ�c(HCO3��)>c(NO2��>c(CO32��)��
(4)���볣��Kbֻ���¶ȸı䣬����ʱ��CH3NH2+H2OCH3NH3++OH�������μ�ϡ������c(CH3NH2)=c(CH3NH3+)ʱ��Kb=![]() =c(OH-)����c(OH-)= Kb=10-3.4mol/L����c(H+)=
=c(OH-)����c(OH-)= Kb=10-3.4mol/L����c(H+)=![]() =10-10.6������pH=-lg10-10.6=10.6��
=10-10.6������pH=-lg10-10.6=10.6��
��ˣ�������ȷ���ǣ�10.6��
(5) ���ø�˹���ɽ���-�ٿɵ�CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)
��H=����189.2 kJ�� mol��1��-��+210.5kJ�� mol��1��=-399.7 kJ�� mol��1��
��ˣ�������ȷ���ǣ�-399.7��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������п���Ʊ���������п���ɱ��ͣ�ѡ���Ժã��乤����������:

(1)��������Ҫ�ɷֵĻ�ѧʽΪ___________��
(2)��ȡҺ�к�����Pb2+��Cu2+���ؽ������ӣ��ɼ����Լ����ȥ���Լ���Ϊ___________����ʵ�ʲ��������м�����Զ���������������ܵ�ԭ����___________��
(3)���ˢ��õ�Zn(NH3)4CO3��Һ����ˮ�������ȷ���������ʽ [ZnCO3��2Zn(OH)2��H2O]�������䷴Ӧ��ѧ����ʽΪ___________��
(4)���������л��в��ְ����ݳ������õ绯ѧ����������������NH3�ĺ�����ԭ����ͼ��ʾ�������ĵ缫��ӦΪ___________�����������������ݳ�����16.8L (��״��)���봫��������һ����Ҫͨ���״����O2�����Ϊ___________��

(5)�������ʱ����Һ�в��ఱ������С��0.2mol/L�������ఱŨ�ȹ��ͣ�ˮ�������������հ�ˮ�а�Ũ�Ƚ��ͣ�������ѭ��ʹ�ã������ఱŨ�ȹ��ߣ��ᵼ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ͪ�������ɱ�淽���ر�Զ����нϺõ�ɱ�����ã��ҹ���ѧ���о���һ�����ͪ�����ĺϳ�·�����£�

�ش��������⣺
(1)A�Ļ�ѧ����Ϊ ______��
(2) B�к��������ŵ�������_____��
(3) B��C�ķ�Ӧ������_____��
(4)д��C����������������Һ��Ӧ�Ļ�ѧ����ʽ_____��
(5) D�Ľṹ��ʽΪ_____��
(6)д����B��Ϊͬ���칹�����ʹFe3+��ɫ���ܷ���ˮ�ⷴӦ�Ļ�����Ľṹ��ʽ(�˴Ź�������Ϊ����壬�������Ϊ1 : 2 : 2 : 3) _____��
(7)������ɱ��Ӻ������Ϊ��ʼԭ���Ʊ�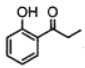 �ĺϳ�·��(���Լ���ѡ) _____��
�ĺϳ�·��(���Լ���ѡ) _____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǹ�[(CH3COO)2CrH2O]Ϊש��ɫ���壬��������ˮ���������ᣬ����������������������ռ���һ���Ʊ����������ڷ����ϵ�����ý���п����ԭ���������۸�(��Һ����ɫ)��ԭΪ���۸�(��Һ������ɫ)�����۸������������Һ���ü����Ƶô����Ǹ���ʵ��װ�����£���ش��������⣺

(1)ʵ������������ˮ���辭��к�Ѹ����ȴ��Ŀ����___________________������a��������___________��
(2)��������п����������������c�У�������������ˮ����ͼ���Ӻã���K1��K2���ر�K3����ʱ�۲쵽c����Һ����ɫ��Ϊ����ɫ���÷�Ӧ�����ӷ���ʽΪ_____________________������п��������______________________________________________��
(3)��K3���ر�K1��K2���۲쵽����Ϊ___________________________��d�г���ש��ɫ������Ϊ�õ�������ש��ɫ���壬���ȡ�IJ�����__________��__________��ϴ�ӡ����
(4)װ��d���ܴ��ڵ�ȱ��Ϊ_________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���a�ͱ�ͨ����Ӧ�ϳ�b�Ĺ��̿ɱ�ʾΪ��ͼ(��С���Ӳ�����ȥ)������˵���������

A. �÷�Ӧ��ȡ����Ӧ
B. ��RΪ��CH3ʱ��b������̼ԭ�ӹ���
C. ��RΪ��C4H9ʱ����b�б����ϵ�һ�ȴ�����ܵĽṹ����12��
D. ��RΪ��C4H5Oʱ��1mol b��������4molH2�ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]
Prolitane��һ�ֿ�����ҩ��Է�����AΪԭ�ϵĺϳ�·�����£�

��ش��������⣺
(1)D�Ļ�ѧ����Ϊ___________��D��E�ķ�Ӧ����Ϊ___________��
(2)G�Ĺ���������Ϊ___________��
(3)B�Ľṹ��ʽΪ______________________��
(4)F��G�Ļ�ѧ����ʽΪ______________________��
(5)X��D��ͬϵ������ӱ�D������һ��̼ԭ�ӣ����ܷ���������Ӧ���������������X����___________��(���������칹)�������˴Ź���������ʾΪ5��壬��������Ϊ3�U2�U2�U2�U1��д�����ϸ�Ҫ�������һ��ͬ���칹��Ľṹ��ʽ��______________________��
(6)���� Prolitane�ĺϳ�·�ߣ����һ���ɱ����Ҵ�Ϊԭ���Ʊ������������ĺϳ�·��(�������Լ����ܼ���ѡ)��____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ������NH4����Cl����Ũ�ȱ�Ϊ1:1����Һ������NH4Cl��Һ�м���( )
��������HC1 ��������NH4NO3 �������İ�ˮ ��������NaOH
A. �٢� B. �ڢ� C. �ۢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(SiHCl3)���Ʊ����顢�ྦྷ�����Ҫԭ�ϣ��ش��������⣺
(1)SiHCl3�ڴ��������·�����Ӧ:
2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g) ��H1 = +48kJ/mol
4SiHCl3(g) = SiH4(g) + 3SiCl4(g) ��H3 = +114kJ/mol
��Ӧ3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)�ġ�H=______________kJ/mol��
(2)���ڷ�Ӧ2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g)�����ú��ʵĴ�������323 K��343 KʱSiHCl3��ת������ʱ��仯�Ľ����ͼ��ʾ��

��323 Kʱ��Ӧ��ƽ��ת���ʨ� =______%���Ƚ�a��b����Ӧ���ʴ�С����a_____��b(�>������<������=��)
����343 K�£�Ҫ���SiHCl3ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_______��Ҫ���̷�Ӧ�ﵽƽ���ʱ�䣬�ɲ�ȡ�Ĵ�ʩ��_______��(���ʾ�������ѡ����ѡ����ʵ�ѡ�����)
A������Ӧ��Ũ��
B������ѹǿ
C����ʱ���������ϵ����
D��ʹ�ø���Ч�Ĵ���
��ij�¶�(T K)�£��÷�Ӧ��ʹSiHCl3��ƽ��ת���ʴﵽ30%������¶��µ�ƽ�ⳣ��KT K___K343 K(�>������<������=��)����֪��Ӧ���ʦ�=����-����=k��x2(SiHCl3)-k��x(SiH2Cl2)x(SiCl4)��k����k���ֱ�Ϊ��������Ӧ���ʳ�����xΪ���ʵ��������������ڸ��¶��µ�ת����Ϊ20%��ʱ�̣�����/����=_____________(����1λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���谢���ӵ�������ֵΪNA������������ȷ����
A. ��������N2O��CO2�У���������ΪNA
B. 3.1g 31P��3.2g 32S�У���������Ϊ1.6NA
C. 0.4 mol BaCl2��0.4 mol Na2O2�У�����������Ϊ0.8NA
D. 1mol��������1mol�춡���У���ѧ������Ϊ14NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com