
【题目】T0℃时,在2 L的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
图a 图b
图b
A.该反应的正反应是吸热反应
B.T1℃时,若该反应的平衡常数K =50,则T1<T0
C.图a中反应达到平衡时,Y的转化率为37.5%
D.T0℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-1
【答案】B
【解析】
根据图a,反应在3min时达到平衡,反应物为X、Y,生成物为Z变化量分别为0.25mol、0.25mol、0.5mol,则方程式为X(g)+Y(g)![]() 2Z(g);根据图b,T1时,达到平衡时用的时间较短,则T1> T2,从T1到T2,为降低温度,X的物质的量减小,平衡正向移动,则正反应为放热反应。
2Z(g);根据图b,T1时,达到平衡时用的时间较短,则T1> T2,从T1到T2,为降低温度,X的物质的量减小,平衡正向移动,则正反应为放热反应。
A. 分析可知,该反应的正反应是放热反应,A错误;
B. 根据图a,T0时,K0=0.252/(0.025![]() 0.075)=33.3,T1℃时,若该反应的平衡常数K =50,K0<K,则T0 到T1,平衡正向移动,正反应为放热,则为降低温度,T1<T0,B正确;
0.075)=33.3,T1℃时,若该反应的平衡常数K =50,K0<K,则T0 到T1,平衡正向移动,正反应为放热,则为降低温度,T1<T0,B正确;
C. 图a中反应达到平衡时,Y的转化率=0.25/0.4=62.5%,C错误;
D. T0℃,从反应开始到平衡时:v(X)=(0.3-0.05)/(2![]() 3)=0.042 mol·L-1·min-1,D错误;
3)=0.042 mol·L-1·min-1,D错误;
答案为B。


科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:
。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g) △H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10—16,K稳[Ag(CN)2—]=1.0×10-21,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]()
![]() N2O4其相关图像如下。
N2O4其相关图像如下。

①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(C1O2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。C1O2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照以下实验装置制备C1O2并验证其某些性质。
请回答下列问题:
(1)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是___,该加热方式的优点是_____。
(2)通入氨气的主要作用有两个,一是可以起到搅拌作用,二是____。
(3)B装置的作用是___。C装置用来吸收C1O2,则C中液体易选用下列___(填序号)。
①热水 ②冰水 ③饱和食盐水
(4)装置D中C1O2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中生成这两种钠盐的化学方程式为____。饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O23H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.___;b.___;c.洗涤;d.干燥。
(5)设计一个简易实验证明二氧化氯具有永久的漂白性:___。
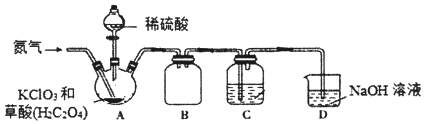
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.聚维酮的单体是![]() B.聚维酮分子由(m+n)个单体聚合而成
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
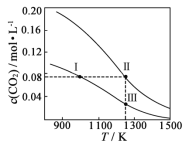
A.反应CO2(g)+C(s) ![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4是重要的清洁能源和化工原料,CH4和CO2都是产生温室效应的主要气体,且前者影响更大。
(1)二氧化碳的电子式为______________。
(2)25℃、101Kpa下,1g CH4完全燃烧生成液态水和CO2放热55.64kJ,则表示CH4燃烧热的热化学方程式为:__________________________________。
(3)CH4和CO2反应可以生成价值更高的化工产品,在250℃、以镍合金为催化剂,向2L密闭容器中通入4mol CH4和6mol CO2发生反应如下:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。平衡时甲烷的物质的量为1mol。
2CO(g)+2H2(g)。平衡时甲烷的物质的量为1mol。
①计算此温度下,该反应的平衡常数K=_________mol2/L2。
②下列各项不能说明该反应处于平衡状态的是_________。
A.容器中的压强恒定 B CH4的转化率恒定
C.容器中气体的密度恒定 D. CH4与CO物质的量之比恒定
(4)甲烷-空气碱性(KOH为电解质)燃料电池的负极反应式为_________________。相同条件下甲烷燃料电池与氢气燃料电池的能量密度之比为________。(能量密度之比等于单位质量可燃物完全反应转移的电子数之比)
(5)科学家以CO2和H2为原料合成乙烯,6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H20(g),已知温度对CO2平衡转化率和催化剂催化效果的影响如图所示,请回答下列问题:
CH2=CH2(g)+4H20(g),已知温度对CO2平衡转化率和催化剂催化效果的影响如图所示,请回答下列问题:

①生成乙烯的速率:v(M)有可能大于v(N),其理由是_________________。
②若投料比n(H2):n(CO2)=4:1,则图中M点时,C2H4的体积分数为_______%。
③若想提高C2H4的产率,可采取的措施有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
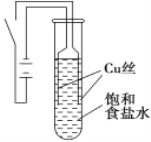
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜 | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e═ H2↑+ 2OH
C.从实验看出氢氧化亚铜具有不稳定性
D.试管底部红色的固体具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池正极板材料为 NiOOH,负极板材料为吸氢合金(MHn), 下列关于该电池的说法中正确的的是

A.放电时电池内部H+向负极移动
B.充电时,将电池的负极与外接电源的正极相连
C.放电时负极的电极反应式为:MHn-ne- =M + nH+
D.充电时阳极反应为:Ni(OH)2 + OH- -e- =NiOOH +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下KW=10-12,则0.05mol/LH2SO4溶液的pH=____ ,0.01mol/LNaOH溶液的pH=______ 。
(2)下列叙述中与盐类的水解有关的是(______)
①明矾和FeCl3可作净水剂
②实验室配制AlCl3溶液时,应先把它溶在较浓的盐酸中,然后加水稀释
③为保存FeCl3溶液,要在溶液中加少量盐酸
④用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑤实验室盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞
⑥NH4Cl与ZnCl2溶液可作焊接中的除锈剂
⑦长期使用硫酸铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用
A.①④⑦ B.②⑤⑦ C.③⑥⑦ D.全部有关
(3)若1 mol N2完全转化为NH3的反应热为△H=-92 kJ/mol,拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)已知25℃ 时,醋酸的Ka=1.8×10-5 碳酸的Ka1=4.3×10-7 Ka2=5.6×10-11 。有①NaHCO3溶液②CH3COONa溶液③NaOH溶液④Na2CO3各25 mL,浓度均为0.1 mol·L-1四种溶液的pH由大到小的顺序为_________ (填序号)
(5)Na2CO3溶液加热后碱性增强,结合化学平衡移动原理解释原因:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com