
【题目】19世纪中叶,门捷列夫的突出贡献是( )
A. 提出原子学说
B. 提出分子学说
C. 发现元素周期律
D. 提出电离学说
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究氯气的性质并用Cl2制备HClO,设计如下实验方案,请回答下列问题:
实验一:性质探究
设计图3实验装置来制备并验证氯气的性质,部分夹持设计未画出。
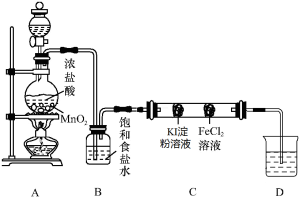
图3
(1)请写出装置A中制备氯气的反应化学方程式______________________;
(2)装置B的作用是______________________;
(3)双通管C中事先装有两个沾有相关试剂的棉球,实验现象为_____________;
实验二:制备HClO
(4)设计图4所示装置E代替图3中的装置C,用于制备较高浓度的HClO溶液。在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙。


图4
①该方案反应后所得的溶液中HClO浓度比氯水中大的原因是_______________
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除CaCl2、HClO外,还含有__________
③该小组同学测得反应中碳酸钙质量减少a g,反应后从所得的100mL溶液中取用10mL与稀盐酸混合,连接F装置测得产生的气体体积为b L(已换算成标准状况),则原溶液中CaCl2的浓度为 mol·L-1(用含a、b的代数式表示,可不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1mol/L的氢氧化钠与0.06mol/L硫酸溶液等体积混合,该混合溶液的PH等于( )
A. 1.7 B. 2.0 C. 12.0 D. 12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3物质结构与性质】已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满。请回答下列问题:
(1)写出E的价层电子排布式 。
(2)A、B、C、D电负性由小到大的顺序为________(填元素符号)。
(3)E(BD)4为无色或黄色挥发性剧毒液体,熔点-19.3℃,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ,E与BD之间的作用力为 。
(4)①写出一种与BD32-互为等电子体的分子的化学式 。
②含F2+的溶液与K2SO4、氨水反应可得到化合物 [F(NH3)4]SO4。1 mol配合物离子[F(NH3)4]2+中含σ键的数目为 。

③ E元素与镧(La)元素的合金可做储氢材料,该晶体的晶胞如图所示,晶胞中心有一个E原子,其他E原子都在晶胞面上,则该晶体的化学式为 ;已知该合金的摩尔质量为M gmol-1,晶胞参数为a pm,用NA表示阿伏伽德罗常数,则该晶胞的密度为 g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀6.99 g。另一份溶液,先将Fe3+还原为Fe2+,再用0.1600 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。该聚合硫酸铁样品中a:b的比值为(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)。
A.1∶1 B.2∶1 C.3∶1 D.2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题。
甲:用可溶性铝盐与稀氨水反应制取氢氧化铝。写出该反应的离子方程式: 。
乙:根据右图电解装置制取氢氧化铝。请回答:

(1) 电源中A极是 极,铝极的电极反应式为 ;
(2)从原理分析,电解质NaCl的作用是 。
丙:利用铝屑、稀H2SO4、NaOH溶液为主要原料制取Al(OH)3固体。
(1)先设计了如下三种方案:
Ⅰ Al3+→Al(OH)3
Ⅱ Al→AlO2-→Al(OH)3
Ⅲ ![]()
从节省原料的角度分析,你认为最合理的方案是 。(填Ⅰ、Ⅱ或Ⅲ)
(2)设计了如下实验步骤:
①配制500 mL 0.5 molL-1NaOH溶液所用到的仪器有:托盘天平(含砝码)、烧杯、玻璃棒、 ;
②在烧杯A中加入50 mL 0.5 molL-1NaOH溶液,再加入足量铝屑给溶液稍加热。其作用是 ,用蒸馏水把铝屑冲洗,干燥后称其质量为m1 g(全部用于制氢氧化铝);
③在盛有适量稀H2SO4的烧杯B中放入 g(含m1的式子表示)铝屑,充分搅拌使铝屑反应完全;
④在盛有适量浓NaOH溶液的烧杯C中入一定质量的铝屑,充分搅拌使铝屑反应完全。该反应的化学方程式为 ;
⑤将烧杯B和烧杯C中的溶液混合,得到氢氧化铝白色沉淀;
⑥将沉淀过滤、洗涤、干燥得Al(OH)3固体m2 g。
试计算此实验中Al(OH)3的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL浓度为2mol.L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A. 加入适量6 mol.L-1的盐酸
B. 加入少量醋酸钠固体
C. 加热
D. 加入少量金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是 ( )
A. 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
B. 将植物油倒入水中用力搅拌形成油水混合物
C. 一束平行光线射入氢氧化铁胶体里,从侧面可以看到一条光亮的通路
D. 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com