
| A、Fe3+>Cu2+>MnO4->Cl2 |
| B、Cu2+>Fe3+>Cl2>MnO4- |
| C、MnO4->Cl2>Fe3+>Cu2+ |
| D、Cl2>MnO4->Cu2+>Fe3+ |


科目:高中化学 来源: 题型:
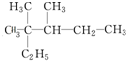
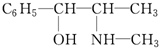 麻黄素中含氧官能团的名称是
麻黄素中含氧官能团的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将142g Na2SO4溶于少量水后再稀释到 100mL |
| B、1 L溶液中含有142 g Na2SO4 |
| C、1 mol Na2SO4溶于1 L蒸馏水中 |
| D、溶液中含有1molNa+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的NaClO 溶液中含有ClO-的数目为NA |
| B、标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA |
| C、铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标况下) |
| D、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由“C(石墨)→C(金刚石)△H=+1.9 kJ/mol”可知金刚石比石墨稳定 |
| B、在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
| C、在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol |
| D、HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H=-(2×57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| B、氧化镁与稀盐酸混合:MgO+2H+=Mg2++H2O |
| C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D、稀盐酸滴在石灰石上:CaCO3+2H+=Ca2++H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向含有Hg2+的废水中加入Na2S:Hg2++S2-═HgS |
| B、用碳酸氢钠作为抗酸药来中和胃酸 2H++CO32-═H2O+CO2↑ |
| C、用熟石灰来中和酸性废水 Ca(OH)2+2H+═Ca2++2H2O |
| D、用H2SO4来中和碱性废水 2H++2OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
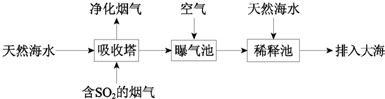
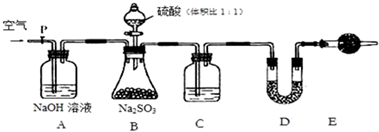
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com