
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 6.02×1023就是阿伏加德罗常数
B. 1 mol水中的氢原子数目为2NA
C. 阿伏加德罗常数个粒子的物质的量是1 mol
D. 1 mol 氨气所含原子数约为2.408×1024个
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用NA表示,下列叙述正确的是
A.18克液态水与18克冰中氢键数目均为NA
B.工业酸性废水中的Cr2O72-可转化为Cr3+除出,现用电解的方法模拟该过程,阴极为石墨,阳极为铁,理论上电路中每通过6mol电子,就有NA个Cr2O72-被还原
C.标准状况下,22.4LNO2含有的原子数小于3NA
D.1molLiAlH4在125℃完全分解成LiH、H2、Al,转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车目前一般使用镍氢电池(M表示储氢合金;汽车在刹车或下坡时,电池处于充电状态)。镍氢电池充放电原理的示意图如下:

其总反应式为![]() 。根据所给信息判断,下列说法错误的是
。根据所给信息判断,下列说法错误的是
A. 混合动力汽车上坡或加速时,乙电极的电极反应式为:NiOOH+H2O+eˉ==Ni(OH)2+OHˉ
B. 混合动力汽车上坡或加速时,电解液中OHˉ向甲电极移动
C. 混合动力汽车下坡或刹车时,甲电极周围溶液的pH减小
D. 混合动力汽车下坡或刹车时,电流的方向为:甲电极→发动机→乙电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA (g) + bB (s) ![]() cC (g) + dD (g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
cC (g) + dD (g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
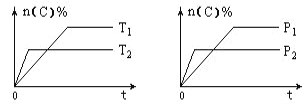
A. 温度降低,化学平衡向逆反应方向移动
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a <c+d
D. 无法根据图像确定改变温度后化学平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
B.0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1NA
C.1 L 0.5 mol·L-1醋酸钠溶液中阴、阳离子总数目大于NA
D.0.1 mol环氧乙烷(![]() )中含有共价键的总数约为0.3×6.02×1023
)中含有共价键的总数约为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25 mL0.12 mol/L AgNO3溶液中逐滴加入浓度为2%的氨水,先出现沉淀,继续滴加沉淀溶解。该过程中加入氨水的体积V与溶液中lg 的关系如图所示。已知e点时溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述不正确的是( )
的关系如图所示。已知e点时溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述不正确的是( )

A.a点溶液呈酸性的原因是AgNO3水解
B.b点溶液中:c(Ag+)+c[Ag(NH3)2+]<c(NO3-)
C.由e点可知,反应Ag++2NH3![]() [Ag(NH3)2]+平衡常数的数量级为105
[Ag(NH3)2]+平衡常数的数量级为105
D.c~d段加入的氨水主要用于沉淀的生成和溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni元素在生产、生活中有着广泛的应用。回答下列问题:
(1)基态Ni原子价层电子的排布式为_______。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行______。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是___,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为_____(填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)解释CO比N2的熔沸点高的原因___。
(6)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为___。
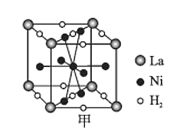
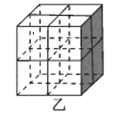
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的___(填“八面体空隙”或“四面体空隙”)。若晶体的密度为d g/cm3,Mg2NiH4的摩尔质量为M g/mol,则Mg2+和Ni原子的最短距离为___nm(用含d、M、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元弱碱B(OH)2在水中存在如下电离平衡:B(OH)2 ![]() B(OH)++OH-,Kb1=10-3.75;B(OH)+
B(OH)++OH-,Kb1=10-3.75;B(OH)+![]() B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是
B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是

A. a点所得的溶液中:c[B(OH)2]= c[B(OH)+]
B. b点所得的溶液中:c[B(OH)2] +c(OH-)=c(B2+)+c(H+)
C. c点所得的溶液中:c(Cl-)<3c[B(OH)+]
D. d点所得的溶液中:c(B2+)>c[B(OH)+]>c[B(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:
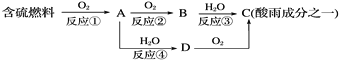
回答下列问题:
①酸雨的pH________(填“>”、“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为_________________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:__________________,反应中氧化剂是____________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n molNO2和m molNO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________ mol·L1。
②若所得溶液中c(NO3—)∶c(NO2—)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=______。
③用含n和m的代数式表示所得溶液中NO3—和NO2—浓度的比值c(NO3—)∶c(NO2—)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com