
【题目】下列关于σ键和π键的理解不正确的是( )
A.σ键可以绕键轴旋转,π键不能绕键轴旋转
B.H2分子中的σ键是s-s σ键,HClO分子中的σ键都是p-pσ键
C.C2H4分子和N2H4中都是含有5个σ键
D.σ键以“头碰头”方式重叠,π键以“肩并肩”方式重叠
科目:高中化学 来源: 题型:
【题目】钼![]() 是一种重要的过渡金属元素,工业上由钼精矿
是一种重要的过渡金属元素,工业上由钼精矿![]() 主要成分是
主要成分是![]() 制备单质钼和钼酸钠晶体
制备单质钼和钼酸钠晶体![]() 的流程如下:
的流程如下:

![]() 中Mo元素的化合价为______;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为______。
中Mo元素的化合价为______;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为______。
![]() 流程中由
流程中由![]() 溶液获得晶体的操作是______、过滤、洗涤、干燥。加入
溶液获得晶体的操作是______、过滤、洗涤、干燥。加入![]() 溶浸时发生的主要反应的离子方程式为______。
溶浸时发生的主要反应的离子方程式为______。
![]() 操作1中,所得
操作1中,所得![]() 溶液中含
溶液中含![]() 杂质,其中
杂质,其中![]() ,
,![]() ,在结晶前需加入
,在结晶前需加入![]() 固体以除去溶液中的。当
固体以除去溶液中的。当![]() 开始沉淀时,
开始沉淀时,![]() 的去除率是______。
的去除率是______。![]() 、
、![]()
![]() ,溶液体积变化可忽略
,溶液体积变化可忽略![]()
![]() 工业上钼精矿在酸性条件下,加入
工业上钼精矿在酸性条件下,加入![]() 溶液,也可以制备钼酸钠,该法的优点是______。
溶液,也可以制备钼酸钠,该法的优点是______。
![]() 高纯Mo可用于制造电池级
高纯Mo可用于制造电池级![]() ,
,![]() 电池是一种性能优异的二次电池,其电池反应为:
电池是一种性能优异的二次电池,其电池反应为:![]()
![]()
![]() 该电池放电时正极反应为______;充电时
该电池放电时正极反应为______;充电时![]() 移动方向为______
移动方向为______![]() 填“由阳极移向阴极”或“由阴极移向阳极”
填“由阳极移向阴极”或“由阴极移向阳极”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.pH=1的硫酸溶液1L,溶液中含SO42-的数目等于0.1NA
B.真空密闭容器中充入0.1molH2和0.1molI2充分反应后,容器内分子总数为0.2NA
C.10mL0.1molL-1的FeCl3与20mL0.1molL-1KI溶液反应,转移电子数为0.001NA
D.60gSiO2晶体中Si-O键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 3.2g铜溶于过量的浓硝酸完全反应生成的气体的物质的量一定为0.1mol
B. 78gNa2S和Na2O2的混合物中阳离子与阴离子的个数比不能确定
C. 25℃HCN的电离平衡常数为5.0×10-10,则浓度均为0.10mol·L-1NaCN和HCN的混合溶液中有c(Na+)>c(CN-)>c(OH-) >c(H+)
D. Fe(NO3)2溶液中加入过量的HI溶液:Fe2++NO3-+4H++2I-=I2+Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )

A. 燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室用如图所示的装置制取乙酸乙酯。
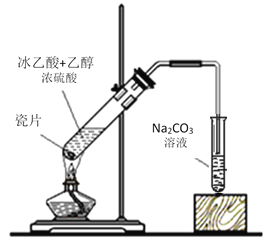
(1)浓硫酸的作用是:① _______________;② ______________。
(2)右边装置中通蒸气的导管要插在液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是____________。
(3)分离得到乙酸乙酯的方法是________________,分离需要的玻璃仪器是___________。
(4)若加的是C2H518OH写出制乙酸乙酯的方程式___________。
II.某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出乙醇催化氧化的化学方程式____________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是_______反应。
(2)甲和乙两个水浴作用不相同。甲的作用是_________;乙的作用是___________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是__________。集气瓶中收集到的气体的主要成分是____________。
(4)图中丙处导管应倾斜的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙醇为原料,用下述6种类型的反应:①氧化,②消去,③加成,④酯化,⑤水解,⑥加聚,来合成乙二酸乙二酯(![]() )的正确顺序是( )
)的正确顺序是( )
A. ①⑤②③④B. ①②③④⑤
C. ②③⑤①⑥D. ②③⑤①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s)△H1
NH2COONH4(s)△H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
①反应Ⅰ的△H1=__。
②一定温度下,在体积固定的密闭容器中按n(NH3):n(CO2)=2:1进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是__(填序号)。
A.容器内气体总压强不再变化
B.NH3与CO2的转化率相等
C.容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__。
②该反应为__(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为__℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,此时反应向__(填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO![]() (aq)
(aq)![]() PbCO3(s)+SO
PbCO3(s)+SO![]() ( aq)。
( aq)。
已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K=__。
Ⅱ.N2H4—O2燃料电池是一种高效低污染的新型电池,其装置如图所示:
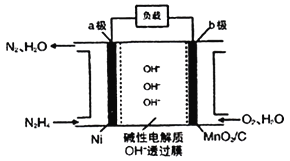
(1)N2H4的电子式为__;
(2)a极的电极反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
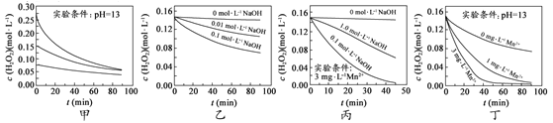
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com