
| ||
| ||
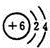 ,
,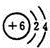 ;
;
| ||
| ||


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 30.8g熟石膏(2CaSO4?H2O)中的钙离子数目为0.2NA.
30.8g熟石膏(2CaSO4?H2O)中的钙离子数目为0.2NA.| A、2个 | B、3个 | C、4个 | D、5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
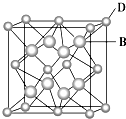 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
如图所示是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )| A、大理石和稀硫酸制取二氧化碳 |
| B、锌粒和稀硫酸制氢气 |
| C、浓盐酸和二氧化锰制取氯气 |
| D、固体NH4Cl和消石灰制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 RCH2CHO+R′CH2CHO
RCH2CHO+R′CH2CHO| OH- |

| -H2O |
| △ |
 ,R、R′表示烃基或氢原子;
,R、R′表示烃基或氢原子;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com