
| C |
| D |
| C |
| D |
 ,
, ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| A、加入催化剂,不能改变该化学反应的反应热 |
| B、b曲线是加入催化剂时的能量变化曲线 |
| C、该反应的热化学方程式为:N2(g)+3H2(g)???2NH3(g),△H=-92 kJ/mol |
| D、在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
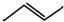 .有机物X的键线式为
.有机物X的键线式为 .下列说法不正确的是( )
.下列说法不正确的是( )| A、X的化学式为C8H8 |
B、有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式: |
| C、X能使酸性高锰酸钾溶液褪色 |
| D、X与足量的H2在一定条件下反应可生成环状饱和烃Z,Z的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| B | ||
| …A | X | C… |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 正极 | Cu | Ag | 石墨 | Mg |
| 负极 | Zn | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | CuSO4 | CuCl2 | Cu(NO3)2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com