
【题目】实验室用二氧化锰和浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器装置如下图所示:

(1)上述装置中的错误一处是________(填“①”、“②”或“③”)。
(2)②装置的作用是___________。
(3)⑤装置中氢氧化钠的作用是吸收氯气,发生的化学反应方程式为______________。
(4)200g36.5%的盐酸(过量)与17.4gMnO2反应,理论上能产生标准状况下氯气的体积是________L,参加反应的盐酸的物质的量是________。提示:MnO2+4HCl![]() MnCl2+2H2O+Cl2↑要求:用物质的量进行计算;有解题步骤。(不按要求解题,零分。)
MnCl2+2H2O+Cl2↑要求:用物质的量进行计算;有解题步骤。(不按要求解题,零分。)
【答案】③ 除去Cl2中HCl气体 2NaOH+Cl2=NaCl+NaClO+H2O 4.48 0.8 mol
【解析】
①制取装置:MnO2+4HCl![]() MnCl2+2H2O+Cl2↑②洗气瓶中盛有饱和氯化钠溶液,导管长进短出,除去挥发出来的HCl气体③洗气瓶中盛有浓硫酸,导管长进短出,除去Cl2中的水蒸气④向上排空气法收集氯气⑤防止造成污染,除去未反应的氯气。
MnCl2+2H2O+Cl2↑②洗气瓶中盛有饱和氯化钠溶液,导管长进短出,除去挥发出来的HCl气体③洗气瓶中盛有浓硫酸,导管长进短出,除去Cl2中的水蒸气④向上排空气法收集氯气⑤防止造成污染,除去未反应的氯气。
(1)上述装置中的错误的是③,导管应该长进短出;
答案:③;
(2)②装置的作用是除去Cl2中HCl气体;
答案:除去Cl2中HCl气体;
(3)⑤装置中氢氧化钠的作用是吸收氯气,发生的化学反应方程式为2NaOH+Cl2=NaCl+NaClO+H2O;
答案:2NaOH+Cl2=NaCl+NaClO+H2O ;
(4)n(MnO2)=![]() =0.2mol;
=0.2mol;
MnO2 + 4HCl ![]() MnCl2+ 2H2O+ Cl2↑
MnCl2+ 2H2O+ Cl2↑
1mol 4mol 22.4L
0.2mol n(HCl) V(Cl2)
根据![]() =
=![]() ,得n(HCl)=0.8mol;根据
,得n(HCl)=0.8mol;根据![]() =
=![]() ,得V(Cl2)=4.48L;
,得V(Cl2)=4.48L;
答案:4.48;0.8 mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:
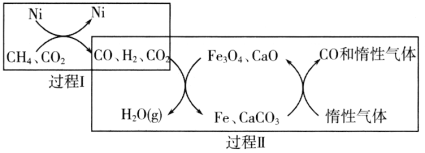
①已知相关反应的能量变化如图所示:

过程Ⅰ的热化学方程式为________。
②关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是________。
(2)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________(kPa)2。(用各物质的分压代替物质的量浓度计算)
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中![]() ,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑色金属是指铁、铬、锰及其合金,在生产生活中有着广泛的用途。请回答下列问题:
(l)基态铬原子核外存在___ 对自旋相反的电子,其未成对电子有____种空间伸展方向。铁和锰的第三电离能(I3)较大的是____(填元素符号),原因是____。
(2)环戊二烯![]() ,无色液体,熔点-97.5℃,沸点40. 0℃,存在于煤焦油中。
,无色液体,熔点-97.5℃,沸点40. 0℃,存在于煤焦油中。
①环戊二烯物质中存在的微粒间相互作用有____
A 范德华力 B 氢键 C δ键 D π键
②环戊二烯分子中碳原子的杂化轨道类型是_____
③配合物中配体提供电子对的方式包括孤对电子、π电子等。二茂铁的分子结构如图所示,其中铁的配位数是____。

(3)金属锰的一种面心立方晶胞结构示意图如图所示,已知锰原子半径为141. 4pm,则该晶胞参数a= ___。由于晶体缺陷造成晶体结构中部分原子缺失,测得实际密度为5. 52g·cm-3,Mn元素相对原子质量按为54. 94计算,此晶胞的缺陷率为____(缺陷率为单位体积内缺失原子数占应有原子总数的百分比)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )

A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。

下列分析不正确的是
A. 乙烯气相直接水合反应的H<0
B. 图中压强的大小关系为:p1>p2>p3
C. 图中a点对应的平衡常数K =![]()
D. 达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验装置与实验目的对应的是( )
|
|
|
|
A用海水制蒸馏水 | B将碘水中的碘单质与水直接分离 | C除去Fe(OH)3胶体中的FeCl3 | D稀释浓硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。

请按要求填空:
(1)A装置中甲仪器名称为______。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
① A中乙为MnO2固体,甲中盛有浓盐酸,则烧瓶中发生反应的化学方程式为_____________。
② 若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
Ⅰ. 将氯水滴入品红溶液中,现象________________。
Ⅱ. 氯水中加入 NaHCO3粉末,有无色气泡产生,某同学得出结论:氯气与水反应的产物具有较强的酸性。请你评价该同学的结论是否合理?若不合理,请说明理由。 ___________________
③E装置的作用__________________。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),关闭止水夹c,制得NO2,接着再进行有关实验。
① 欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹_____,再打开止水夹_____,使烧杯中的水进入试管丁的操作是_________________。
② NO2尾气可用NaOH溶液吸收生成两种钠盐,写出反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温2L密闭容器中通入气体X并发生反应:2X(g) ![]() Y(g) ΔH<0,X的
Y(g) ΔH<0,X的
物质的量n(x)随时间t变化的曲线如下图所示(图中两曲线分别代表有无催化剂的情形)

(1)下列措施不能提高反应速率的是____。
A 升高温度 B 加入适量X C 增大压强 D 及时分离出Y
(2)反应从开始到a点的平均反应速率可表示为v(Y)=_____,X的转化率为____;
(3)____线表示使用催化剂的情形(填“实”或“虚”);
(4)图中c点对应的速率关系是![]() (正)____
(正)____![]() (逆) (填“大于”“小于”或“等于”);
(逆) (填“大于”“小于”或“等于”);
(5)反应进行到a点时放出的热量 _______反应进行到b点时放出的热量(填“大于”“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com