
【题目】实验小组制备高铁酸钾(K2FeO4) 并探究其性质。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中化学反应的还原剂是_______。
②装置B的作用是除杂,所用试剂为___________。
③C中得到紫色固体和溶液。C中的反应有:3Cl2 + 2Fe(OH)3+ 10KOH=== 2K2FeO4 + 6KCl+ 8H2O
此反应表明:氧化性Cl2______FeO42-(填“>”或“<”)。
④C中除了发生③中的反应,还发生化学反应:__________。
(2)探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
①此实验可证明氧化Cl-的物质只能是FeO42-。用KOH溶液洗涤的目的是__________。
②此实验得出Cl2和FeO42-的氧化性强弱关系与制备实验时得出的结论相反,原因是_______________。
【答案】浓盐酸(或Cl-) 饱和食盐水 > Cl2+2OH-===Cl-+ClO-+H2O (2分)(化学/离子方程式均可) 排除ClO-干扰 二者酸碱性环境不同
【解析】
综合应用氧化还原知识,解答K2FeO4的制备和性质问题,注意氧化性或还原性强弱与溶液的酸碱性有关。
(1)①装置A中生成的氯气是浓盐酸失电子生成,反应的还原剂是浓盐酸(或Cl-)。
②A中生成的氯气中混有HCl杂质,装置B中用饱和食盐水除去HCl。
③C中反应:3Cl2 + 2Fe(OH)3+ 10KOH=== 2K2FeO4 + 6KCl+ 8H2O,其中Cl2得电子生成KCl,Cl2是氧化剂;
Fe(OH)3失电子生成K2FeO4,K2FeO4是氧化产物,故:氧化性Cl2>FeO42-。
④氯气通入C中,可直接与KOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O。
(2)①上述方法制得的K2FeO4中可能混有KClO和KCl,其中KClO也能将盐酸氧化为氯气,故用KOH溶液洗涤以排除ClO-干扰。
②K2FeO4与盐酸反应生成Cl2,说明氧化性FeO42->Cl2。与制备实验时得出的结论相反,因为二者酸碱性环境不同。


科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为______________。
②Fe的基态原子共有_________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4═2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_____(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为_____________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10﹣2 nm和7.8×10﹣2 nm.则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
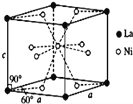
①该晶体的化学式为_____________。
②已知该晶胞的摩尔质量为M gmol﹣1,密度为d gcm﹣3.设NA为阿伏加德罗常数的值,则该晶胞的体积是_____ (用含M、d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素W、X、Y、Z的原子序数依次增加。p、q、r是由这些元素组成的二元化合物,m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体。

请回答下列问题:
(1)X 元素的最高价氧化物对应的水化物的阴离子构型为________________。
(2)n在水中溶解度_________(填“大于”或“小于”)n在p中溶解度,理由是:______________。
(3)n 与p 反应的化学方程式为:______________。
(4)分子式为X4W8的有机物有______________种同分异构体(考虑顺反异构)。
(5)下列化合物中属于p的同系物的是______________。
A. B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去粗盐中的杂质CaCl2、MgCl2和Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是
A. 除去Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓
B. 试剂①一定不是Na2CO3溶液
C. 检验SO42-是否除净:取少量滤液,加稀盐酸酸化,再加BaCl2溶液
D. 滤液加稀盐酸时只发生反应: H+ +OH- =H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能够在碱性溶液中大量共存,且溶液呈无色透明的是( )
A.K+、Cu2+、Cl-、SO42-B.Na+、CO32-、SO42-、Cl-
C.NO3-、Na+、CO32-、Ba2+D.Na+、NO3-、H+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按题目要求填写下列空白。
(1)CH3OOCH按官能团的不同分类,有机物类型为____________类;
(2)![]() 按官能团的不同分类,有机物类型为____________类;
按官能团的不同分类,有机物类型为____________类;
(3)将(CH3)2CHCH(CH3)CH(CH3)CH2CH3按系统命名法命名________________________。
(4)将(CH3)2C=CH-CH=CHCH3按系统命名法命名________________________。
(5)燃烧等质量的四种烃:①C2H6 ②C4H8 ③C6H14 ④C7H8,消耗氧气最多的是____________。(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com