
 xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.怎样在一定时间内快出产品是运用了化学反应速率理论 |
| B.怎样使用有限原料多出产品是运用了化学平衡理论 |
| C.怎样提高原料转化率是运用了化学反应速率理论 |
| D.怎样使原料尽可能多地转化为产品是运用了化学平衡理论 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。  CO2转化率(%) CO2转化率(%)n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2SO3,的平衡常数K=19,在该温度下的体积
2SO3,的平衡常数K=19,在该温度下的体积 固定的密闭容器中充
固定的密闭容器中充 入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率
入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率 为80%时,该反应
为80%时,该反应 (填“正反应”或“逆反应”) 方向进行。
(填“正反应”或“逆反应”) 方向进行。 cC(g)+dD(g) △H = a kJ·mol
cC(g)+dD(g) △H = a kJ·mol -1;
-1;查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2NO(g)+O2(g)。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)
2NO(g)+O2(g)。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学方程式 | K (t1 ) | K (t2) |
  2 2 | 1.8  |  |
   |  |  |
   |  |  |
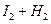  2HI 2HI | 43 | 34 |
 生成HX,用原子结构解释原因: 。
生成HX,用原子结构解释原因: 。 化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。 的转化率逐渐降低
的转化率逐渐降低 与
与 反应的剧烈程度逐渐减弱
反应的剧烈程度逐渐减弱查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe
Fe
 +S
+S
 ,
, )·c(s
)·c(s )=ksp。常温下ksp=8.1×10-17。(溶液密度为1.0g/cm3)。
)=ksp。常温下ksp=8.1×10-17。(溶液密度为1.0g/cm3)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com