
【题目】已知破坏1mol H﹣H键、1mol I﹣I键、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘单质反应生成2mol HI需要放出kJ的热量.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知:25 ℃时, Kb(NH3·H2O)=1.8×10-5。 该温度下,用 0.100mol·L-1 的氨水滴定 10.00 mL 0.100mol·L-1 的一元酸 HA 的溶液, 滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法不正确的是

A. HA 为强酸
B. a=10
C. 25 ℃时,NH4+的水解平衡常数为![]()
D. 当滴入 20 mL 氨水时,溶液中存在 c(NH4+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:
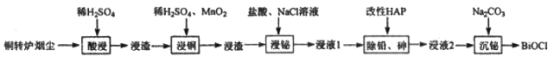
请回答:
(1)Bi位于第六周期,其原子结构示意图为__________________________________。
(2)向“酸浸”所得浸液中加入Zn粉,充分反应后过滤,从溶液中获得ZnSO4·7H2O的操作为__________、过滤、洗涤、干燥。
(3)“浸铜”时,有单质硫生成,其离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“除铅、砷”时,可以采用以下两种方法。
①加入改性HAP。浸液1与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125:1 | 50:1 | 25:1 | 15:1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=_________________________。
②铁盐氧化法,向浸液1中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。欲使溶液中c(AsO42-)<10-9mol/L且不产生Fe(OH)3沉淀,应控制pH的范围为__________。
已知:1g2=0.3:;FeAsO4、Fe(OH)3的Ksp分别为5×10-23、4×10-38。
(6)“沉铋“时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前能源危机是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法不利于能源“开源节流”的是________(填字母)。
A.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
B.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
C.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
D.减少资源消耗、增加资源的重复使用和资源的循环再生

(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。则在通常状况下,金刚石和石墨相比较,_________(填 “金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=______________。
(3)N2、O2分子中化学键的键能分别是946 kJ/mol、497kJ/mol。已知:N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol。NO分子中化学键的键能为_____。
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山银山,我国科研人员在探究如何降低大气中氮氧化物与碳氧化物的含量方面做出了巨大贡献,并取得了显著的成绩。
(1)下列关于氮氧化物与碳氧化物的说法中正确的是_____(填字母)。
A.CO2、NO2均属于酸性氧化物
B.NO、CO均不能用排空气法收集
C.除去NO中混有的NO2的方法是将混合气体通入足量氢氧化钠溶液中
D.除去CO中混有的CO2的方法是将混合气体通入足量氢氧化钠溶液中
(2)已知:N2(g)+O2(g)![]() 2NO(g)ΔH1=+180.5kJ/mol;
2NO(g)ΔH1=+180.5kJ/mol;
CO(g)![]() C(s)+1/2O2(g)ΔH2=+110.5kJ/mol;
C(s)+1/2O2(g)ΔH2=+110.5kJ/mol;
C(s)+O2(g)![]() CO2(g)ΔH3=-393.5kJ/mol。
CO2(g)ΔH3=-393.5kJ/mol。
则反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)ΔH=__________
N2(g)+2CO2(g)ΔH=__________
(3)反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)可用于净化汽车尾气,已知570K时该反应的反应速率极慢,平衡常数极大。由此可知,提高尾气净化效率的最佳途径是_________;若要净化汽车尾气的同时提高该反应的反应速率和NO的转化率,且只改变一个反应条件,则应采取的措施是_________。
2CO2(g)+N2(g)可用于净化汽车尾气,已知570K时该反应的反应速率极慢,平衡常数极大。由此可知,提高尾气净化效率的最佳途径是_________;若要净化汽车尾气的同时提高该反应的反应速率和NO的转化率,且只改变一个反应条件,则应采取的措施是_________。
(4)某科研小组根据反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)来探究起始反应物的碳氨比[n(CO)/n(NO)]对污染物去除率的影响。T℃时,向体积为1L的恒容密闭容器中充入总物质的量为4mol的NO和CO混合气体,并加入一定量的固体催化剂进行反应,实验测得平衡体系中气体组分的转化率和氯气的体积分数的变化如图所示.
N2(g)+2CO2(g)来探究起始反应物的碳氨比[n(CO)/n(NO)]对污染物去除率的影响。T℃时,向体积为1L的恒容密闭容器中充入总物质的量为4mol的NO和CO混合气体,并加入一定量的固体催化剂进行反应,实验测得平衡体系中气体组分的转化率和氯气的体积分数的变化如图所示.

①根据图像推测曲线转化率1表示的是______ (填“CO”或“NO”)。
②A点时,n(CO)/n(NO)=_________,此时反应的平衡常数K= __________(请填写数值与单位)。
(5)煤炭在O2/CO2的气氛中燃烧会产生CO,有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。该提议_______(填“可行”或“不可行”), 理由是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列说法正确的有( )
A.1molNa2O2晶体中共含有4NA个离子
B.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
C.常温常压下16gO2和O3混合气体含有NA个氧原子
D.1mol/LNa2CO3溶液中含有NA个CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25s内的反应进程.
(1)前20秒内O2的平均生成速率:mol/(Ls)
(2)在某温度下达到平衡后,不改变其他条件,向该容器中再加入少量的NO2 , 平衡移动的方向是 , NO2的平衡转化率 68.75%(填“>”、“<”或“=”),NO的体积百分含量 (填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下:
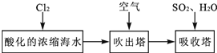
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)
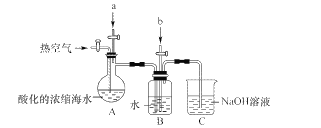
(1)A装置中通入a气体的目的是(用离子方程式表示)____。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是____。
(3)B装置中通入的b气体是____,目的是使溴蒸气转化为氢溴酸以达到富集的目的,试写出该反应的化学方程式____。
(4)C装置的作用是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com