
����Ŀ���ѱ���Ϊ����ʮһ���ͽ���������ҵ�����������Ʊ������ѵĹ����������£�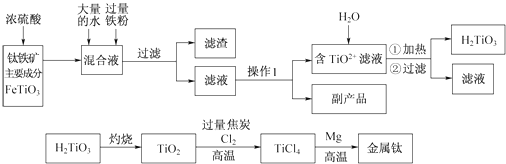
��֪����������Ҫ�ɷ���Ũ���ᷴӦ����Ҫ������TiOSO4��FeSO4 �� TiOSO4��ˮ��ˮ�⣮
��ش��������⣺
��1������1�õ��IJ����������ձ���� �� ����2�������ˣ�����Ʒ��Ҫ�ɷֵĻ�ѧʽΪ
��2�����ϻ�ѧ������ͽ�TiO2+ת��ΪH2TiO3��ԭ��
��3����֪�ѵĻ�ԭ�Խ�������п֮�䣬����������ʴ��ԭ��֮һ�� �� ����ɴ�Za��Zn��Fe���ֽ�����ѡһ�ֽ������������е�þ����ô�ý��������Ȼ��ѷ�Ӧ�Ļ�ѧ����ʽ��
��4�����TiO2�����Ti����TiO2��������ʯīΪ����������CaOΪ����ʣ���̼�������ۣ���������Ӧ�ĵ缫��ӦʽΪ
��5��Ϊ�ⶨ��Һ��TiOSO4�ĺ���������ȡ������Һ10mL��ˮϡ����100mL���ӹ������ۣ������ʹ����ȫ��Ӧ��3TiO2++Al+6H+�T3Ti3++AlO3++3H2O�������˺�ȡ����Һ20.00mL�������еμ�2��3��KSCN��Һ��ָʾ����������һ�ֲ������������ƣ��μ�0.1000molL��1FeCl3��Һ������Ti3++Fe3+�TTi4++Fe2+ �� ����Һ���ֺ�ɫ�ﵽ�ζ��յ㣬��ȥ��30.00mLFeCl3��Һ��������Һ��TiOSO4�����ʵ���Ũ���� ��
���𰸡�
��1��©����������������Ũ������ȴ�ᾧ��FeSO4
��2����Һ�д���ƽ�⣺TiO2++2H2O?H2TiO3+2H+ �� ��������ˮϡ�͡����º�ƽ�������ƶ�������H2TiO3
��3���ѱ����γ�һ�����ܵ�����Ĥ�����ѵ��ڲ��ṹ���ܣ���TiCl4+4Na ![]() Ti+4NaCl
Ti+4NaCl
��4��TiO2 +4e��=Ti+2O2��
��5����ʽ�ζ��ܣ�1.50mol?L��1
���������⣺��1.������1Ϊ�����õ��IJ����������ձ����©����������������2��ʵ�鲽��Ϊ������Ũ������ȴ�ᾧ�����������м����Һ�к���Fe2+���ӣ�����˺�ɵ�FeSO47H2O����FeSO4��������Ʒ��Ҫ�ɷֵĻ�ѧʽΪFeSO4 �� �ʴ�Ϊ��©����������������Ũ������ȴ�ᾧ��FeSO4��
��2.�����ȵ�Ŀ���Ǵٽ�TiO2+ˮ������H2TiO3 �� �����������ȵõ�TiO2����Һ�д���ƽ�⣺TiO2++2H2OH2TiO3+2H+ �� ���������º�
ƽ�������ƶ�������H2TiO3��
�ʴ�Ϊ����Һ�д���ƽ�⣺TiO2++2H2OH2TiO3+2H+ �� ���������º�ƽ�������ƶ�������H2TiO3��
��3.���ѵĻ�ԭ�Խ�������п֮�䣬��������һ�����ܵ�����Ĥ������������ʴ��ԭ���ѱ����γ�һ�����ܵ�����Ĥ�����ѵ��ڲ��ṹ���ܣ������ý����ƿ��Խ��������û�������TiCl4+4Na ![]() Ti+4NaCl��Zn����Fe���Dz����Եģ������Բ
Ti+4NaCl��Zn����Fe���Dz����Եģ������Բ
�ʴ�Ϊ���ѱ����γ�һ�����ܵ�����Ĥ�����ѵ��ڲ��ṹ���ܣ���TiCl4+4Na ![]() Ti+4NaCl��
Ti+4NaCl��
��4.����TiO2���������õ����ӣ�����ԭ��TiO2 +4e��=Ti+2O2�� �� �õ�����Ti��
�ʴ�Ϊ��TiO2 +4e��=Ti+2O2������5��ȷ�μ��Ȼ�����Һ��ʹ�õζ��ܣ��Ȼ����н�ǿ�������ԣ�Ӧ����ʽ�ζ��ܣ�
����ҺTi3+�����ʵ���ΪX��
Ti3+����ɫ�� | + | Fe3+ | + | H2O | = | TiO2+����ɫ�� | + | Fe2+ | + | 2H+ |
1 | 1 | |||||||||
x | 0.1000molL��1��0.03L |
���X=0.1000molL��1��0.03L=0.003mol
�������Һ��TiOSO4�����ʵ���=0.003mol��5=0.015mol
����C= ![]() =
= ![]() =1.50 molL��1
=1.50 molL��1
�ʴ�Ϊ����ʽ�ζ��ܣ�1.50 molL��1 ��
��Ũ���ᴦ����������������Һ�м������ˮϡ�ͺ����������ۻ�ԭ�����ӣ����˵õ���Һͨ������Ũ������ȴ�ᾧ�����˵õ�TiO2+��Һ������ƷFeSO4 �� ��Һ�м���ˮ���ȹ��˵õ�H2TiO3 �� H2TiO3�������յõ�TiO2 �� ��������������̼���¼��ȷ�Ӧ����TiCl4��һ����̼�����Ȼ��Ѻͽ���þ���¼��ȷ�Ӧ�õ��Ȼ�þ���ѽ�������1������1Ϊ���ˣ�����2��ʵ�鲽��Ϊ������Ũ������ȴ�ᾧ�����������м����Һ�к���Fe2+���ӣ�����ԭ���غ��֪����Ϊ��������������˺�ɵ�FeSO47H2O����FeSO4��������Ϊ��������м�Ͳ�������ʯ����2��������Һ�д���ƽ�⣺TiO2++2H2OH2TiO3+2H+ �� ƽ��Ӱ�����غ�ƽ���ƶ�ԭ�������жϣ���3�����ݽ�����������������ʽ����Ϣ���ش𣬽����ƵĻ�����ǿ���������ڽ�����ұ������4�����ݵ��ԭ�����������Ƿ����õ��ӵĻ�ԭ��Ӧ����5��ȷ�μ��Ȼ�����Һ��ʹ����ʽ�ζ��ܣ�����Ԫ���غ���������Һ��TiOSO4�����ʵ�����


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��������[KAl��SO4��212H2O]��ȡ������������صIJ������������ݴ�ͼ�ش��й����⣮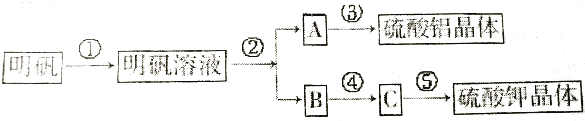
��1�����в�����ʱ��������Լ������ӷ�Ӧ��������A�����е�ʵ����������䷴Ӧ�����ӷ���ʽΪ��
��2�����в�����ʱ����������Լ��� �� ��Ŀ���� �� ��Ӧ�������еIJ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⡿ij�о�С�鰴����·�ߺϳ���ʹҩ����ण�
��֪��
�O�O
��ش�
��1��A��B�ķ�Ӧ��������
��2������˵������ȷ����________��
A.������A������������
B.������B�ɷ�����ȥ��Ӧ
C.������E�ܷ����ӳɷ�Ӧ
D.����वķ���ʽ��C15H21NO2
��3��д��B��C��D�Ļ�ѧ��Ӧ����ʽ��
��4������Լױ�Ϊԭ���Ʊ�C�ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)��
��5��д��ͬʱ��������������C������ͬ���칹��Ľṹ��ʽ��
�ٷ������б��������DZ�������λ��ȡ���
��1H-NMR�ױ�����������6����ԭ�ӣ�IR����ʾ����̼��˫����C��N����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ijҩ����п��������ã��Ʊ���ҩ������һ����ӦΪ�� 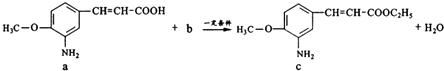
����˵������ȷ���ǣ� ��
A.a�вμӷ�Ӧ�Ĺ��������Ȼ�
B.������b����ȼ�Ϻ��ܼ�
C.c��������ˮ
D.�÷�Ӧ����Ϊȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL��ijϡH2S04��Һ�е���0.1mol/L��ˮ����Һ��ˮ�����������Ũ������˰�ˮ����仯��ͼ�����з�����ȷ���ǣ� �� 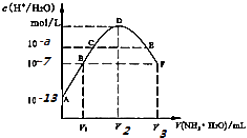
A.ϡ�����Ũ��Ϊ0.1mol/L
B.C����ҺpH=14��a
C.E��Һ�д��ڣ�c��NH4+����c��SO42������c��H+����c��OH����
D.B��D,D��F���Ӱ�ˮ���һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڼס������ձ���Һ�У������д�����Cu2+��Na+��H+��SO ![]() ��CO
��CO ![]() ��OH����6�����ӣ���֪���ձ�����Һ����ɫ�������ձ�����Һ�д������ڵ������ǣ� ��
��OH����6�����ӣ���֪���ձ�����Һ����ɫ�������ձ�����Һ�д������ڵ������ǣ� ��
A.Cu2+��H+��SO ![]() ?
?
B.Na+��OH����CO ![]()
C.CO ![]() ��OH����SO
��OH����SO ![]()
D.Na+��H+��SO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������õ���ֱ�ӻ������������ǣ� ��
A. FeCl2B. COC. SO2D. NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ���ḻ���ʱ��⣬ͨ����ˮ���ۺ����ÿɻ���������ʹ�����ʹ�ã�
��1����ˮ���εĿ������ã�
�ٺ�ˮ����Ŀǰ�����Ϊt�����������ѡ��Զ�뽭���뺣�ڣ�������꣬��ϫ��������ƽ̹�տ��ĺ�̲�����������Ϊ��ˮ�ء������غ��أ�
��Ŀǰ��ҵ�ϲ��ñȽ��Ƚ������ӽ���Ĥ���۷������ȼҵ�������ڵ����������ӽ���Ĥֻ����������ͨ������ֹ�����Ӻ�����ͨ������˵���ȼ������������ӽ���Ĥ�����ã���дһ�㼴�ɣ���
��2�����������ǽ��귢չ���һ�ֽϺõĺ�ˮ������������ԭ����ͼ��ʾ�����о���ѡ���Ե������ӽ���Ĥ�������ӽ���Ĥ������У���ش���������⣺
�ٺ�ˮ����ֱ��ͨ�˵��������У������� ��
��A���ų����������ˮ����Ũˮ����
��3���ÿ�±����Na+��K+��Mg2+��Cl����Br�������ӣ�����ȡ�壬�������������� 
�����������е���Һ��BrO3�� �� ���������з�Ӧ�����ӷ���ʽΪ��
��ͨ�����Ȼ��ѻ�ú�Br2����Һ��Ϊ�λ��辭�����������ա��ữ���»�ú�Br2����Һ�� ��
������������ͨ��ˮ�������ȣ������¶���90�����ҽ��������ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ʳ������Ա仯�ľ��������ǣ� ��
A. Ԫ��ԭ�Ӱ뾶��С�������Ա仯
B. Ԫ��ԭ�������ε���
C. Ԫ��ԭ�����������Ų��������Ա仯
D. Ԫ�ص���������ϼ۳������Ա仯
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com