
【题目】铁及其化合物在生活中有广泛应用。
(1)Fe2+基态的电子排布式为___。
(2)实验室用Fe3+检验苯酚。苯酚分子中碳原子的杂化方式为___。
(3)以Fe和BN为原料合成的铁氮化合物在光电子器材领域有广泛应用。
①以氨硼烷(NH3BH3)为原料可以获得BN。氨硼烷的结构式为___(配位键用“→”表示),氨硼烷易溶于水,其主要原因是___。
②以硼烷和氨气为原料可合成氨硼烷。NH3属于___分子(填“极性”或“非极性”)。
③如图为Fe与N所形成的一种化合物的基本结构单元,该化合物的化学式为___。

【答案】1s22s22p63s23p63d6或[Ar]3d6 sp2 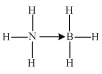 氨硼烷分子与水分子间存在氢键 极性 Fe4N
氨硼烷分子与水分子间存在氢键 极性 Fe4N
【解析】
(1)铁元素的原子序数为26,失去2个电子形成亚铁离子;
(2)苯酚分子中苯环上的6个碳原子的杂化方式为sp2杂化;
(3)①氨硼烷中氮原子提供一对共用电子对给硼原子形成配位键,氨硼烷中氮原子能与水分子间形成氢键;
②氨气分子的空间构型为三角锥形,结构不对称;
③由晶胞结构可知,铁原子位于顶点和面心,氮原子位于体心,由分摊法计算分子式。
(1)铁元素的原子序数为26,失去2个电子形成亚铁离子,根据原子核外电子排布规律可知,亚铁离子的基态核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6,故答案为1s22s22p63s23p63d6 或[Ar]3d6;
(2)苯酚分子中苯环上的6个碳原子的杂化方式为sp2杂化,故答案为:sp2;
(3)①氨硼烷中氮原子具有孤电子对,硼原子具有空轨道,氮原子能提供一对共用电子对给硼原子形成配位键,则氨硼烷的结构式为 ;氨硼烷中氮原子能与水分子间形成氢键,则氨硼烷能溶于水,故答案为:
;氨硼烷中氮原子能与水分子间形成氢键,则氨硼烷能溶于水,故答案为:  ;氨硼烷分子与水分子间存在氢键;
;氨硼烷分子与水分子间存在氢键;
②氨气分子的空间构型为三角锥形,结构不对称,属于极性分子,故答案为:极性;
③由晶胞结构可知,铁原子位于顶点和面心,个数为8×![]() +6×
+6×![]() =4,氮原子位于体心,个数为1,则晶胞中铁原子和氮原子的数目之比为4:1,化学式为Fe4N,故答案为:Fe4N。
=4,氮原子位于体心,个数为1,则晶胞中铁原子和氮原子的数目之比为4:1,化学式为Fe4N,故答案为:Fe4N。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
![]() 联氨
联氨![]() 常温下为液态,在空气中迅速完全燃烧生成
常温下为液态,在空气中迅速完全燃烧生成![]() ,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
已知:![]() 的燃烧热为
的燃烧热为![]()
![]() ;
;![]()
![]() ;
;![]()
则![]() 在空气中燃烧生成气态水的热化学方程式为______。
在空气中燃烧生成气态水的热化学方程式为______。
![]() 工业上利用氨气生产氢氰酸
工业上利用氨气生产氢氰酸![]() 的反应为
的反应为![]()
![]() 。
。
![]() 一定温度下,向2L恒容容器中充入1mol
一定温度下,向2L恒容容器中充入1mol![]() 和2mol
和2mol![]() 发生上述反应,8min达到平衡时,测得
发生上述反应,8min达到平衡时,测得![]() 的转化率为
的转化率为![]() ,
,![]() 内,用
内,用![]() 表示的该反应速率v
表示的该反应速率v![]() ______。
______。
保持温度和容积不变,再向平衡后的容器中充入![]()
![]() 和
和![]() HCN,此时
HCN,此时![]() ______
______![]() 选填“
选填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 在
在![]() 下,将a
下,将a![]() 的NaCN溶液与
的NaCN溶液与![]() 的盐酸等体积混合,反应后测得溶液
的盐酸等体积混合,反应后测得溶液![]() ,则a______
,则a______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;用含a的代数式表示HCN的电离常数
;用含a的代数式表示HCN的电离常数![]() ______。
______。
![]() 能够和
能够和![]() 形成
形成![]() 。
。
![]() 溶液中存在
溶液中存在![]()
![]()
![]()
![]()
![]() 时,其平衡常数的表达式为
时,其平衡常数的表达式为![]() ______。
______。
![]() 高剂量的亚硝酸盐有很大毒性,电化学降解
高剂量的亚硝酸盐有很大毒性,电化学降解![]() 的原理如图:
的原理如图:
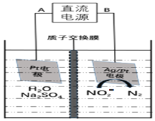
![]() 阴极反应式为______。
阴极反应式为______。
![]() 若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差
若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差![]() 为______g。
为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
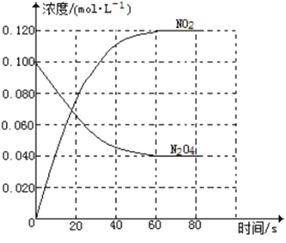
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用煤化工所得的苯可合成甲苯、乙苯、环己烷,其反应如下:
①![]()
![]()
![]() (甲苯)
(甲苯)![]()
②![]()
![]()
![]()
 (乙苯)
(乙苯)
③![]()
![]()
![]()
![]() (环己烷)
(环己烷)
下列说法正确的是( )
A.反应①、②、③均属于加成反应
B.溴水中加入苯,二者可发生取代反应
C.甲苯中所有原子一定在同一平面上
D.能用溴的四氯化碳溶液判断反应②所得的乙苯中是否混有乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的恒容密闭容器中充入气体A和气体B发生反应生成气体C,反应过程中各组分的物质的量随反应时间的变化如图所示。下列说法正确的是( )
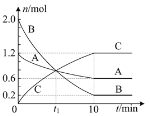
A.t1时刻反应达到平衡状态
B.0~10min内平均速率v(B)=0.18mol·L-1·min-1
C.该反应的化学方程式可表示为:A+3B![]() 2C
2C
D.该温度下,反应的平衡常数为1200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子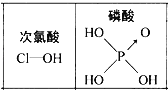
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1 ℃和T2 ℃时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
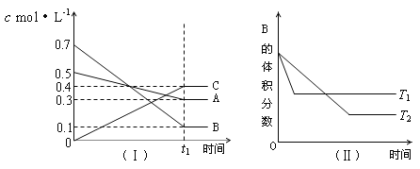
A.该平衡体系的化学反应方程式为:A(g)+B(g)![]() C(g)
C(g)
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动
C.T1<T2
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)检验气体中是否含有CO的实验操作:将该气体通入氯化钯(PdCl2)溶液中,观察是否有黑色的单质钯生成,写出对应的化学方程式:_______________。
(2)生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式:_________________。
(3)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:______________________________。
(4)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿(主要成分为CuFeS2)转化成硫酸盐,该过程反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,能实现实验目的的是(必要时可加热)( )
选项 | 实验目的 | 甲中物质 | 乙中物质 | 丙中物质 |
|
A | 证明浓硫酸具有强氧化性 | 浓硫酸 | 碳粉 | 溴水 | |
B | 验证Cl2无漂白性 | 浓盐酸 | MnO2 | 干燥的红色布条 | |
C | 比较H2CO3和H2SiO3的酸性 | 稀硫酸溶液 | 碳酸钠 | 硅酸钠溶液 | |
D | 验证NH3溶于水显碱性 | 浓氨水 | 碱石灰 | 湿润的蓝色 石蕊试纸 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com