
【题目】(1)检验气体中是否含有CO的实验操作:将该气体通入氯化钯(PdCl2)溶液中,观察是否有黑色的单质钯生成,写出对应的化学方程式:_______________。
(2)生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式:_________________。
(3)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:______________________________。
(4)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿(主要成分为CuFeS2)转化成硫酸盐,该过程反应的离子方程式为____________________。
【答案】CO+PdCl2+H2O=CO2+Pd+2HCl 3Na2SO4+8C![]() 3Na2S+4CO2↑+4CO↑ MnO2+H2O2+2H+=Mn2++O2↑+2H2O 4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O
3Na2S+4CO2↑+4CO↑ MnO2+H2O2+2H+=Mn2++O2↑+2H2O 4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O
【解析】
(1)CO与氯化钯(PdCl2)在溶液中反应能产生黑色金属钯、CO2和一种酸,据此该反应的化学反应方程式;
(2)Na2SO4与C混合高温煅烧,产生Na2S、CO、CO2,根据原子守恒、电子守恒,书写方程式;
(3)酸性条件下MnO2与H2O2反应产生O2、H2O、Mn2+;
(4)根据反应物和生成物结合质量守恒定律书写反应的离子反应方程式。
(1)依题意将CO通入氯化钯(PdCl2)溶液中,生成单质钯,根据氧化还原反应原理及元素守恒,可知反应产物中还应该有CO2和HCl,该反应的化学方程式为:CO+PdCl2+H2O=CO2+Pd+2HCl;
(2)依题意Na2SO4与C反应生成Na2S和等物质的量的CO和CO2,根据氧化还原反应得失电子数相等,配平方程式即得3Na2SO4+8C![]() 3Na2S+4CO2↑+4CO↑;
3Na2S+4CO2↑+4CO↑;
(3)依题意,在酸性条件下H2O2被MnO2氧化为O2,MnO2被还原为Mn2+,则该反应的离子方程式为:MnO2+H2O2+2H+=Mn2++O2↑+2H2O;
(4)在酸性溶液中利用氧气可以将黄铜矿氧化成硫酸盐,则应有硫酸参加反应,且生成硫酸铜,硫酸铁和水,反应的方程式为4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,离子反应方程式为:4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O。


 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室模拟“侯氏制碱法”原理,以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
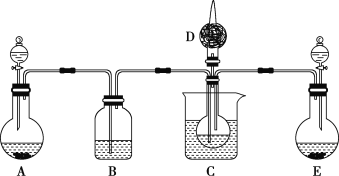
①E中制备气体时,所需药品是___(填字母)。
a.石灰石 b.生石灰 c.稀盐酸 d.浓氨水
②B中应盛有___溶液。在实验过程中,应向C中先通入足量的__。
③E装置向C中通气的导管不能插入液面下的原因是___。
(2)该小组同学为了测定C中所得碳酸氢钠晶体的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为4g。再将晶体加热到质量不再变化时,称量所得粉末质量为mg。然后进行如图所示实验:
![]()
![]()
![]()
![]()
![]()
![]()
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,正确的实验操作是:在加入氯化钙溶液后,___。
②操作Ⅲ涉及的步骤名称为___、___、干燥。
③所得晶体中碳酸氢钠的纯度为____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活中有广泛应用。
(1)Fe2+基态的电子排布式为___。
(2)实验室用Fe3+检验苯酚。苯酚分子中碳原子的杂化方式为___。
(3)以Fe和BN为原料合成的铁氮化合物在光电子器材领域有广泛应用。
①以氨硼烷(NH3BH3)为原料可以获得BN。氨硼烷的结构式为___(配位键用“→”表示),氨硼烷易溶于水,其主要原因是___。
②以硼烷和氨气为原料可合成氨硼烷。NH3属于___分子(填“极性”或“非极性”)。
③如图为Fe与N所形成的一种化合物的基本结构单元,该化合物的化学式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯的认识有一个不断深化的过程。已知分子式为![]() 的甲、乙两种物质的结构简式如图所示。
的甲、乙两种物质的结构简式如图所示。
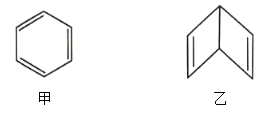
(1)甲、乙的化学性质的区别为甲能___________________(填字母,下同),而乙能___________________。
A.被酸性![]() 溶液氧化
溶液氧化
B.与溴水发生加成反应
C.与氢气发生加成反应
(2)![]() 甲和
甲和![]() 乙分别与
乙分别与![]() 发生完全加成反应,甲消耗___________
发生完全加成反应,甲消耗___________![]()
![]() ,而乙消耗__________
,而乙消耗__________![]()
![]()
(3)![]() 还可能有另一种结构丙(如图所示),其二氯代物有___________________种。
还可能有另一种结构丙(如图所示),其二氯代物有___________________种。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第四周期ⅥA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。
T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为液体H2Se,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石![]() 碳化硅
碳化硅![]() 晶体硅
晶体硅
C.晶格能由大到小:NaF>NaCl>NaBr>NaI
D.熔点由高到低:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是![]()
A.氯化钙溶液中通入![]() 气体:
气体:![]()
B.以石墨作电极电解氯化铝溶液:![]()
![]()
![]()
C.![]() 溶液中通入过量的
溶液中通入过量的![]() 气体:
气体:![]()
D.向明矾溶液中加入氢氧化钡溶液至沉淀的质量最大:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示可逆反应A(g)+3B(g)2C(g) △H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )
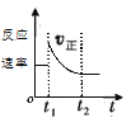
A.t1时降低了温度,平衡向正反应方向移动
B.t1时增大了压强,平衡向正反应方向移动
C.t1时可能使用了催化剂
D.t1时增大了A的浓度,同时减小了C的浓度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() ,为研究影响该反应速率的因素,在不同条件下进行4组实验,Y、Z的起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。下列说法不正确的是( )
,为研究影响该反应速率的因素,在不同条件下进行4组实验,Y、Z的起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。下列说法不正确的是( )

A.若实验②、④只改变一个条件,则由实验②、④得出结论:升高温度,化学反应速率加快
B.若实验①、②只改变一个条件,则由实验①、②得出结论:增大反应物浓度,化学反应速率加快
C.若实验②、③只改变一个条件,则实验③使用了催化剂
D.0~10min内,实验③的平均速率v(Y)=0.04 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com