
【题目】H、C、N、O、Al、S是常见的六种元素.完成下列填空:
(1)碳元素有12C、13C和14C等同位素.在14C原子中,核外存在对自旋相反的电子.
(2)碳在形成化合物时,其所成化学键以共价键为主,原因是 .
(3)任选上述元素可组成多种四原子的共价化合物,请写出其中含非极性键的一种化合物的电子式 .
(4)上述元素可组成盐NH4Al(SO4)2 . 向10mL1mol/L NH4Al(SO4)2溶液中滴加1mol/L的NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下.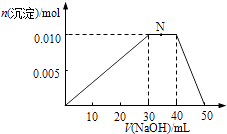
①NH4Al(SO4)2溶液中所有离子的浓度由大到小的顺序是 , 请解释阳离子浓度差异的原因 .
②写出N点反应的离子方程式 .
③若向10mL1mol/L NH4Al(SO4)2溶液中加入20mL1.2mol/LBa(OH)2溶液,充分反应后,产生沉淀mol.
【答案】
(1)2
(2)C有4个价电子且半径较小,难以通过得或失电子达到稳定结构
(3)![]() 或H:CC:H
或H:CC:H
(4)c(SO42﹣)>c(NH4+)>c(Al3+)>c(H+)>c(OH﹣);由于碱性:氨水>Al(OH)3 , 故Al3+的水解程度大于NH4+的水解程度,c(NH4+)>c(Al3+);NH4++OH﹣=NH3H2O;0.022
【解析】解:(1)C原子核外电子排布为1s22s22p2 , 轨道式为如图所示: ![]() ,则在基态14C原子中,核外存在2对自旋相反的电子,故答案为:2;(2)共价键为原子之间以共用电子对成键,碳原子核外有4个电子,且元素的非金属性较弱,但半径较小,反应中难以失去或得到电子,故答案为:C有4个价电子且半径较小,难以通过得或失电子达到稳定结构;(3)上述元素可组成多种四原子的共价化合物,其中含非极性键的物质是H2O2和C2H2 , 电子式分别为
,则在基态14C原子中,核外存在2对自旋相反的电子,故答案为:2;(2)共价键为原子之间以共用电子对成键,碳原子核外有4个电子,且元素的非金属性较弱,但半径较小,反应中难以失去或得到电子,故答案为:C有4个价电子且半径较小,难以通过得或失电子达到稳定结构;(3)上述元素可组成多种四原子的共价化合物,其中含非极性键的物质是H2O2和C2H2 , 电子式分别为 ![]() 、H:CC:H,故答案为:
、H:CC:H,故答案为: ![]() 或H:CC:H;(4)①NH4Al(SO4)2 , 溶液中Al3+、NH4+均水解使溶液呈酸性,由于碱性:氨水>Al(OH)3 , 所以Al3+比 NH4+水解程度更大,c(NH4+)>c(Al3+),故离子浓度由大到小的顺序是:c(SO42﹣)>c(NH4+)>c(Al3+)>c(H+)>c(OH﹣),故答案为:c(SO42﹣)>c(NH4+)>c(Al3+)>c(H+)>c(OH﹣);由于碱性:氨水>Al(OH)3 , 故Al3+的水解程度大于NH4+的水解程度,c(NH4+)>c(Al3+); ②N点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH﹣反应生成NH3H2O,离子方程式为:NH4++OH﹣=NH3H2O,故答案为:NH4++OH﹣=NH3H2O;③10mL 1molL﹣1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42﹣的物质的量为0.02mol,20mL 1.2 molL﹣1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH﹣为0.048mol,由SO42﹣+Ba2+=BaSO4↓,可知SO42﹣不足,故可以得到0.02mol BaSO4 ,
或H:CC:H;(4)①NH4Al(SO4)2 , 溶液中Al3+、NH4+均水解使溶液呈酸性,由于碱性:氨水>Al(OH)3 , 所以Al3+比 NH4+水解程度更大,c(NH4+)>c(Al3+),故离子浓度由大到小的顺序是:c(SO42﹣)>c(NH4+)>c(Al3+)>c(H+)>c(OH﹣),故答案为:c(SO42﹣)>c(NH4+)>c(Al3+)>c(H+)>c(OH﹣);由于碱性:氨水>Al(OH)3 , 故Al3+的水解程度大于NH4+的水解程度,c(NH4+)>c(Al3+); ②N点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH﹣反应生成NH3H2O,离子方程式为:NH4++OH﹣=NH3H2O,故答案为:NH4++OH﹣=NH3H2O;③10mL 1molL﹣1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42﹣的物质的量为0.02mol,20mL 1.2 molL﹣1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH﹣为0.048mol,由SO42﹣+Ba2+=BaSO4↓,可知SO42﹣不足,故可以得到0.02mol BaSO4 ,
Al3++3OH﹣=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH﹣为0.048mol﹣0.03mol=0.018mol,
NH4++OH﹣=NH3H2O
0.01mol 0.01mol
反应剩余OH﹣为0.018mol﹣0.01mol=0.008mol,
Al(OH)3+OH﹣=AlO2﹣+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol﹣0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,故答案为:0.022.
(1)根据同一轨道的2两个电子自选方向相反判断;(2)共价键为原子之间以共用电子对成键,碳的非金属性较弱,但半径较小,反应中难以失去或得到电子;(3)同种元素的原子之间形成非极性键;(4)①溶液中Al3+、NH4+均水解使溶液呈酸性,但Al3+比 NH4+水解程度更大;②N点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH﹣反应生成NH3H2O;③根据n=cV计算n(Al3+ )、n(NH4+)、n(SO42﹣)、n(Ba2+)、n(OH﹣),根据SO42﹣、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++3OH﹣=Al(OH)3↓、NH4++OH﹣=NH3H2O、Al(OH)3+OH﹣=AlO2﹣+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】如图是依据各种元素(原子)的性质与原子序数(1-20)的关系而作出的,各图的纵轴可能代表下列某一性质:核电荷数、中子数、最高正化合价、原子半径、得电子能力,A、B、C分别代表三种元素。注意:图3中原子序数为8、9的元素和图4中原子序数为2、10、 18的元素在纵轴上没有对应的数值。
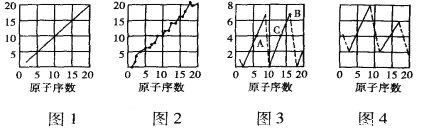
请回答下列问题:
(1)图2、图3、图4的纵轴分别代表的性质是_____、____、______。
(2)B元素的名称是________,工业上制备C的单质的化学反应方程式为______。
(3)元素A和元素C的气态氢化物的沸点高低及原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PAFC{聚合碱式氯化铝铁,通式:[FeaAlb(OH)xCly]n}是一种新型的无机高分子絮凝剂.以高铁铝土矿、硫酸厂渣尘为配料(主要成分:Al2O3、Fe2O3 , 杂质FeO、SiO2等)为原料制取PAFC的实验流程如下: 
(1)为提高“酸溶”速率,除适当增大盐酸浓度外,还可采取的措施有(举一例).
(2)“酸溶”时,Al2O3与盐酸反应的化学方程式为 , 滤渣1的主要成分为(写化学式)
(3)“氧化”时,NaClO3氧化Fe2+ , 本身被还原为Cl﹣ , 该反应的离子方程式为 .
(4)“聚合”时,若将溶液pH调得过高,可能造成的影响是 .
(5)![]() 是衡量PAFC净水效果的重要参数之一,某合作学习小组的同学拟通过实验确定产品中
是衡量PAFC净水效果的重要参数之一,某合作学习小组的同学拟通过实验确定产品中 ![]() 的比值. 步骤1.准确称取5.710g样品,溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350g固体.
的比值. 步骤1.准确称取5.710g样品,溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350g固体.
步骤2.另准确称取2.855g样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.4000g.
①通式[FeaAlb(OH)xCly]n中,a、b、x、y的代数关系式为
②产品中n(Al)/n(Fe)的比值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对有关NaClO和NaCl混合溶液的叙述正确的是( )
A.该溶液中,H+、NH ![]() 、SO
、SO ![]() 、Br﹣可以大量共存
、Br﹣可以大量共存
B.该溶液中,K+、OH﹣、S2﹣、NO3﹣不能大量共存
C.向该溶液中滴入少量FeSO4溶液,离子方程式为:2Fe2++ClO﹣+2H+→Cl﹣+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1molCl2 , 转移电子约为6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,只用水不能鉴别的是( )
A.白色粉末:CuSO4、Na2CO3、CaCO3
B.无色液体:乙醇、苯、四氯化碳
C.白色粉末:NaOH、NaCl、NH4NO3
D.无色液体:苯、甲苯、乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:3X(气)+Y(气)=nZ(气)+2W(气).5min末已生成0.2molW,若测知以Z浓度变化来表示的化学反应平均速率为0.01molL﹣1min﹣1 , 则上述反应中Z气体的计量系数 n的值是( )
A.1
B.2
C.3
D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的
A.正反应活化能小于 100 kJ·mol-1B.逆反应活化能一定小于 100 kJ·mol-1
C.正反应活化能不小于 100 kJ·mol-1D.正反应活化能比逆反应活化能大 100 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将氢气和碘蒸气各1mol的气态混合物充入10L的密闭容器中.发生反应H2(g)+I2(g)=2HI(g).2分钟后达到平衡后.测得C(H2)=0.08molL﹣1 ,
(1)求该反应的平衡常数.
(2)求2分钟内的H2的反应速率.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子反应可用H++OH-= H2O表示的是( )
A. 氢氧化钡和硫酸B. 氢氧化铁和盐酸C. 硝酸和氢氧化铜D. 硫酸氢钠和氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com