
| A. | 增大空气进入量或减小石油气进入量 | |
| B. | 增大空气进入量,增大石油气进入量 | |
| C. | 减小空气进入量,减小石油气进入量 | |
| D. | 减小空气进入量或增大石油气进入量 |
分析 根据已知的反应方程式,来分析相同体积的液化石油气、天然气消耗的氧气的多少,消耗氧气多时需要增大空气的进入量,消耗氧气少的则应减小空气的进入量.
解答 解:由液化石油气的主要成分为C3H8、天然气的主要成分为CH4,
燃烧的化学方程式为C3H8+5O2$\frac{\underline{\;点燃\;}}{\;}$3CO2+4H2O;CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,
显然相同体积的C3H8、CH4,C3H8消耗的氧气多,
则液化石油气为燃料的灶具,欲改为燃烧天然气,
需要减小空气的进入量,增大天然气进量,
故选A.
点评 本题考查学生利用已知信息来分析解答问题,明确相同体积的气体消耗的氧气的量的多少是解答的关键,注重利用化学知识来处理生活中的常见问题,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是化学键 | |
| B. | 甲烷可与水形成氢键 | |
| C. | 乙醇分子跟水分子之间存在范德华力和氢键 | |
| D. | 碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
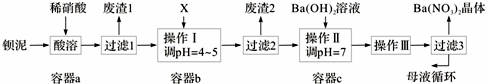
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
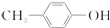 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )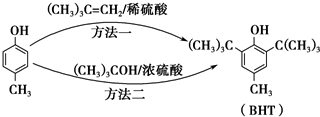
| A. | 推测BHT在水中的溶解度小于苯酚 | |
| B. | 方法一和方法二的反应类型都是加成反应 | |
| C. | BHT与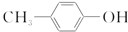 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| D. | BHT与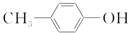 具有完全相同的官能团 具有完全相同的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互称为同分异构体的物质不可能具有相同的通式 | |
| B. | 具有相同官能团的有机物不一定是同系物 | |
| C. | 糖类、油脂、蛋白质都是仅含C、H、O元素的有机物 | |
| D. | 燃烧产物是CO2、H2O的有机物一定烃类 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75% | 11.44% | 13.56% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
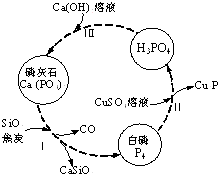 氮、磷及其化合物在科研及生产中均有着重要的应用.
氮、磷及其化合物在科研及生产中均有着重要的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com