
| A. | KI | B. | H2SO4 | C. | NaOH | D. | Na2SO4 |
分析 A.电解碘化钾溶液,阳极碘离子放电生成碘单质,不会生成气体;
B.电解硫酸,实质为电解水,硫酸浓度增大,溶液的pH减小;
C.电解氢氧化钠溶液,实质为电解水,氢氧化钠溶液的浓度增大;
D.电解硫酸钠,实质为电解水,溶液的pH不变.
解答 解:A.电解KI,阳极碘离子放电生成碘单质,阴极氢离子得到电子生成氢气,溶液的pH增大,但是阳极没有气体生成,故A错误;
B.电解H2SO4溶液,阳极氢氧根离子放电生成氧气,阴极氢离子得到电子生成氢气,实质为电解水,电解过程中硫酸的浓度增大,则溶液的pH减小,故B错误;
C.电解NaOH溶液,阳极氢氧根离子放电生成氧气,阴极氢离子得到电子生成氢气,实质为电解水,电解过程中氢氧化钠的浓度增大,则溶液的pH增大,故C正确;
D.电解Na2SO4溶液,阳极氢氧根离子放电生成氧气,阴极氢离子得到电子生成氢气,实质为电解水,电解过程中硫酸钠的浓度增大,但是溶液的pH不变,故D错误;
故选C.
点评 本题考查了电解原理及其应用,题目难度中等,明确电解原理为解答关键,注意题干信息的要求:“两极都有气体生成且电解过程中溶液pH增大”,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:多选题

| A. | 分子式为C3H2O3 | |
| B. | 分子中σ键与π键个数之比为3:1 | |
| C. | 分子中既有极性键也有非极性键 | |
| D. | 分子中碳原子的杂化方式全部为sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
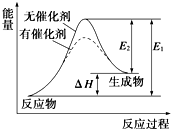 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 该反应的反应热等于E1-E2 | |
| C. | 催化剂能改变该反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组在实验室用如下装置制备氯气.
某化学兴趣小组在实验室用如下装置制备氯气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(D)>r(F)>r(A) | |
| B. | D与C也能形成D2C和D2C2化合物,两种化合物中阳离子和阴离子个数比都为2:1 | |
| C. | 把2mol D的单质投入足量的水中,产生的气体体积为22.4L | |
| D. | 由A、B、C三种元素组成的18电子微粒能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
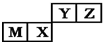
| A. | 原子半径:M>X>Y>Z | |
| B. | M的氯化物是弱电解质 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | 简单离子的半径M小于Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
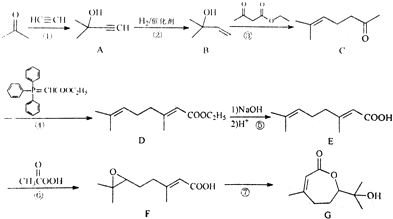
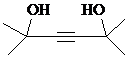 .
.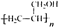 ,写出合成流程图(无机试剂任用).合成流程图示例如下:
,写出合成流程图(无机试剂任用).合成流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,NaA溶液的pH=8,则c(Na+)-c(A-)=9.9×10-7 | |
| B. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>(CH3COO-) | |
| C. | 0.1mol•L-1的NaHSO3的溶液中C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-) | |
| D. | 浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com