
【题目】根据反应:2Ag+ + Cu = Cu2+ + 2Ag,设计如图所示原电池,下列说法错误的是( )。
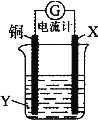
A.X可以是银或石墨
B.Y是硫酸铜溶液
C.电子从铜电极经外电路流向X电极
D.X极上的电极反应式为Ag+ + e-= Ag
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )
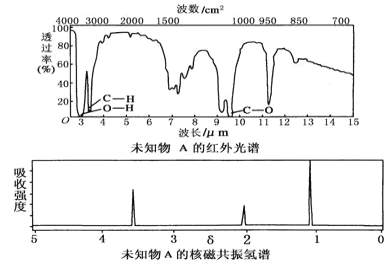
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、Q、W、R的原子序数与其常见化合价关系如图所示。下列说法正确的是
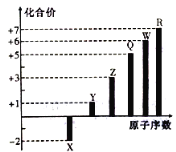
A.X、Y、Z、W、R的简单离子半径大小顺序为R>W>Z>Y>X
B.Q元素形成的可溶性盐的溶液不可能显酸性
C.X、Y、R形成的某种化合物可以用于漂白、消毒
D.Y、Z和W三者最高价氧化物对应的水化物间不能两两相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下左图所示,其中甲池的总反应式为2CH3OH+302+4KOH=2K2CO3+6H20,完成下列问题:

(1)甲池燃料电池的负极反应为___________________。
(2)写出乙池中电解总反应的化学方程式: ___________________。
(3)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生____g沉淀,此时乙池中溶液的体积为400mL,该溶液的pH=____________。
(4)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2 的实验装置(如上右图)。若用于制漂白液,a 为电池的______极,电解质溶液最好用_____。若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用___作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2012年11月某白酒企业生产的白酒被曝塑化剂超标267%,白酒产品中的塑化剂主要源于塑料接酒桶、塑料输酒管、成品酒塑料内盖等。塑化剂DEHP的合成线路如下:
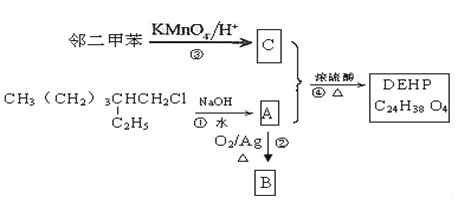
(1)A用系统命名法命名为______________,C分子核磁共振谱中显示有__________种不同化学环境的氢原子。C在一定条件下与乙二醇反应生成的高聚物是一种重要的合成纤维,俗称涤纶,其结构简式是__________。
(2)B含有的官能团名称为__________,①、②的反应类型分别为_______、_______。
(3)写出满足下列条件的C的同分异构体的结构简式:____________。
a.是苯的邻位二元取代物;b.遇FeCl3溶液显示特征颜色;
c.能与碳酸氢钠溶液反应
(4)写出下列反应的化学方程式:
反应②:_______________________________________________;
反应④:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是__(用离子方程式表示)。向该溶液中滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为__mol·L-1。(NH3·H2O的电离平衡常数为Kb=2×10-5)
(2)如图1是0.1mol/L电解质溶液的pH随温度变化的图像。
①其中符合0.1mol/LNH4Al(SO4)2溶液的pH随温度变化的曲线是__(填写字母),导致pH随温度变化的原因是__;
②20℃时,0.1mol/L的NH4Al(SO4)2溶液中2c(SO42-)-c(NH4+)-3c(Al3+)=___(填数值)。
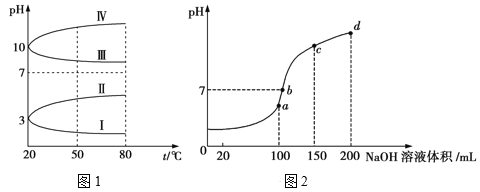
(3)室温时,向100mL0.1mol/L的NH4HSO4溶液中滴加0.1mol/LNaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是__;在b点,溶液中各离子浓度由大到小的排列顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示。下列说法正确的是
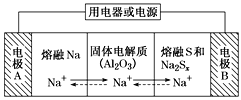
A.放电时,电极A为正极
B.充电时,Na+ 从电极A向电极B迁移
C.充电时,电极B反应式为S22-- 2e- === xS
D.该电池工作的适宜温度应控制在25 ℃左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
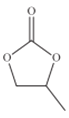
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。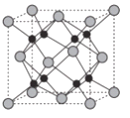
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com