
 2C(g)+2D(g);△H=Q.2min末达到平衡,生成0.8mol D.
2C(g)+2D(g);△H=Q.2min末达到平衡,生成0.8mol D. mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还原该加入B______mol.
mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还原该加入B______mol. 计算反应速率;
计算反应速率; 2C(g)+2D(g),
2C(g)+2D(g), ,K300℃<K350℃,说明升高温度平衡向正反应方向移动,则正反应放热,△H>0,
,K300℃<K350℃,说明升高温度平衡向正反应方向移动,则正反应放热,△H>0, ;>;
;>; =0.8mol/L,
=0.8mol/L,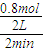 =0.22mol/(L?min),
=0.22mol/(L?min), 2C(g)+2D(g)可知,C和D各
2C(g)+2D(g)可知,C和D各 mol,转化到左边可得A、2mol,B、
mol,转化到左边可得A、2mol,B、 mol.
mol. )mol=2mol:2mol,解得n=
)mol=2mol:2mol,解得n= ,
, .
.

 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
 2C(g)+2D(g);△H=Q.2min末达到平衡,生成0.8mol D.
2C(g)+2D(g);△H=Q.2min末达到平衡,生成0.8mol D.| c2(C)×c2(D) |
| c3(A)×c(B) |
| c2(C)×c2(D) |
| c3(A)×c(B) |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c3(C) |
| c2(A)c(B) |
| c3(C) |
| c2(A)c(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:
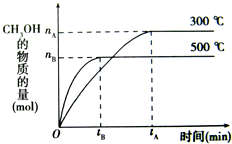 一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)?CH3OH(g)达到平衡状态.
一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)?CH3OH(g)达到平衡状态.| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| ||
| tB |
| ||
| tB |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:长春一模 题型:问答题

| 4 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com