
【题目】一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH)nC16-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
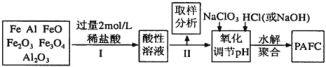
请回答下列问题:
(1)用l0 mol/L的浓盐酸配制2mol/L的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有 。
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管
(2)下列关于PAFC的说法中正确的有( )
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水电离出OH—,是碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(3)步骤Ⅱ中取样分析的目的是( )
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3的量
D.测定溶液中Al3+的含量
(4)写出向溶液中加入NaClO3时,发生反应的离子方程式为______________________。
(5)该化工厂的化验室为测定产品PAFC中A1和Fe的含量,进行下列试剂的选择和基本操作:测定时所需的试剂有_______________。
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
(6)在测定过程中的操作顺序是: 过滤、___________、灼烧、_________、称量。(写操作名称)。
(7)测定时,直接称量的是____________和_____________的质量(填化学式)。
【答案】(15分)
(1)ABD(3分)
(2)AD(2分)
(3)C(2分)
(4)6H++6Fe2++ClO3-==6Fe3++Cl-+3H2O(2分)
(5)BC(2分)
(6)洗涤;冷却(2分)
(7)A2O3;Fe2O3(2分)
【解析】
试题分析:
(1)用l0 mol/L的浓盐酸配制2mol/L的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有烧杯、容量瓶和胶头滴管,答案选ABD。
(2)A.PAFC是一种无机高分子化合物,A正确;B.PAFC中Fe显+3价,B错误;C.PAFC溶于水能电离出OH—,但同时还有氯离子,不是一种碱,C错误;D.能电离出铝离子、铁离子和氢氧根,PAFC在强酸性和强碱性溶液中均不能稳定存在,D正确,答案选AD。
(3)应用溶液中含有亚铁离子需要利用后续的氯酸钠氧化,所以步骤Ⅱ中取样分析的目的是测定溶液中Fe2+的含量,以确定加入NaClO3的量,答案选C。
(4)根据电子得失守恒和原子守恒可知向溶液中加入NaClO3时,发生反应的离子方程式为6Fe2++6H++C1O3- =6Fe3++Cl-+3H2O。
(5)氢氧化铝是两性氢氧化物能与强碱反应生成偏铝酸盐,然后通入二氧化碳转化为氢氧化铝沉淀,灼烧得到氧化铝,二氢氧化铁不能溶于氢氧化钠溶液中,所以测定时所需的试剂有氢氧化钠和二氧化碳,答案选BC。
(6)在测定过程中的操作顺序是:过滤、洗涤、灼烧、冷却、称量。
(7)根据小题5中分析可知测定时,直接测定的是Al2O3,Fe2O3的质量。


科目:高中化学 来源: 题型:
【题目】同温同压下,同体积的气体单质X2和气体单质Y2化合生成气体Z,且反应前后气体体积不变,则Z的化学式为
A. X2Y2 B. X2Y C. XY2 D. XY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性。已知鲨烯分子含有30个C原子及6个C=C且不含环状结构,则其分子式为
A.C30H48 B.C30H50 C. C30H60 D.C30H62
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。

I.请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙__________________;
(2)氯化钠溶液中分离出氯化钠____________________;
(3)分离植物油和水____________________;
(4)分离酒精和水____________________;
(5)氯化钠溶液中分离出水____________________。
II.碘水中提取碘单质的方法如下:
(1)萃取分液
①下列可作为碘水中提取碘单质萃取剂的有__________
A.酒精 B.苯
②分液漏斗在使用前必须先________________;
③查资料得知:ρ(H2O)>ρ(苯)>ρ(酒精),若用①中所选萃取剂萃取碘水中的碘单质,分液时,水层应由分液漏斗的_______端口放出,有机层应由分液漏斗的________端口放出(此问填“上”或者“下”) ;
(2)蒸馏
①冷凝装置中冷凝水应该_______口进(填“上”或“下”)
②已知碘和四氯化碳的熔沸点数据如下表
熔点 | 沸点 | |
碘 | 113.7℃ | 184.3℃ |
四氯化碳 | -22.6℃ | 76.8℃ |
若用蒸馏法分离碘和四氯化碳的混合物,锥形瓶中先收集到的物质的名称是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸
B.相同pH的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:
c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
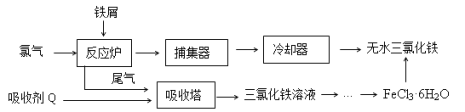
(1)由FeCl3· 6H2O晶体制备无水FeCl3应采取的措施是: 。
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸, 再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol·L-1Na2S2O3溶液滴定用去12.50mL。
已知:I2+2S2O32-=2I-+S4O62-
① 写出加入稍过量的KI溶液反应的离子方程式: 。
② 求样品中氯化铁的质量分数(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
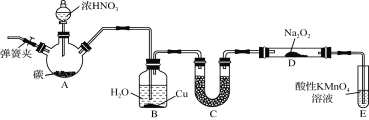
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。
【背景素材】
①2NO+Na2O2===2NaNO2;
②NO能被酸性KMnO4氧化成NO![]() ,MnO
,MnO![]() 被还原为Mn2+。
被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【制备NaNO2】
(1) 装置A三颈烧瓶中发生反应的化学方程式为 。
(2) B装置的目的是① ,② 。
(3) 为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是 (填序号)。
A. P2O5 B. 碱石灰 C. 无水CaCl2 D. 生石灰
(4) E装置发生反应的离子方程式是 。
【测定NaNO2纯度】
(5) 本小题可供选择的试剂有:
A.稀硫酸
B.c1mol·L-1KI溶液
C.淀粉溶液
D.c2mol·L-1Na2S2O3溶液
E.c3mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是 (填序号)。
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解 (请补充完整实验步骤)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com