
【题目】某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2OH
CH3CH2CH2OH
其中CO的制备原理:HCOOH![]() CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)
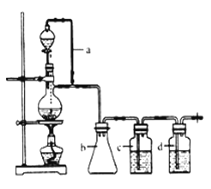
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中可以选择合适的试剂制备氢气、丙烯。写出制备丙烯的化学方程式:_______________________。
(2)若用以上装置制备干燥纯净的CO,装置中a的作用是__________,装置中b的作用是_________,c中盛装的试剂是___________。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是___________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4⑤品红溶液
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)![]() RCH(OH)SO3Na↓;
RCH(OH)SO3Na↓;
②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:

试剂1为______________,操作2为_____________,操作3为_____________。
【答案】(CH3)2CHOH![]() CH2=CHCH3↑+H2O 保证分液漏斗内外压强平衡,便于液体顺利流下 作为安全瓶,防倒吸 NaOH溶液 ④⑤①⑤③② 饱和NaHSO3溶液 萃取 蒸馏
CH2=CHCH3↑+H2O 保证分液漏斗内外压强平衡,便于液体顺利流下 作为安全瓶,防倒吸 NaOH溶液 ④⑤①⑤③② 饱和NaHSO3溶液 萃取 蒸馏
【解析】
根据目标产物及原料的结构特点分析判断由2-丙醇在浓硫酸作用下脱水制备丙烯;根据实验原理及装置特点分析各仪器的作用及所需试剂;根据H2O\二氧化硫、二氧化碳的性质分析检验的方法及顺序;根据提纯路线图中物质的变化分析操作的名称及所用试剂。
(1)根据题干提供的原料分析知,可以用2-丙醇在浓硫酸作用下脱水制备丙烯,反应方程式为:(CH3)2CHOH![]() CH2=CHCH3↑+H2O,故答案为:(CH3)2CHOH
CH2=CHCH3↑+H2O,故答案为:(CH3)2CHOH![]() CH2=CHCH3↑+H2O;
CH2=CHCH3↑+H2O;
(2)根据装置图分析知,导管a可以使得分液漏斗中的压强和烧瓶中压强相等,便于分液漏斗中的液体顺利滴下;制得的CO中含有挥发出的甲酸,可以用NaOH溶液吸收,再用浓硫酸干燥即可得到纯净的CO;装置b可以防止c中液体倒吸进入蒸馏烧瓶,起到安全瓶的作用,故答案为:保证分液漏斗内外压强平衡,便于液体顺利流下;作为安全瓶,防倒吸;NaOH溶液;
(3)首先检验H2O,用无水硫酸铜,若变蓝说明有水,再用品红检验SO2,若品红褪色说明有SO2,用饱和亚硫酸钠溶液可以吸收SO2,再通过酸性高锰酸钾溶液检验SO2是否除尽,最后通入澄清石灰水中,若变浑浊,说明含有CO2,故答案为:④⑤①⑤③②;
(4)由粗品分离出滤液,可见操作1为过滤;则加入试剂1,必须有沉淀生成,故正丁醛中应加入饱和NaHSO3溶液;在滤液中加入乙醚,萃取出1-丁醇,再通过蒸馏将两者分离,所以操作2是萃取,操作3是蒸馏,故答案为:饱和NaHSO3溶液;萃取;蒸馏。


科目:高中化学 来源: 题型:
【题目】如图所示,金属(M)—空气电池具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应为![]() 。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )
。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )

A.电池放电过程中正极发生还原反应
B.比较![]() 、
、![]() 、
、![]() 三种金属—空气电池,
三种金属—空气电池,![]() -空气电池的理论比能量最高
-空气电池的理论比能量最高
C.为防止负极区沉积![]() ,宜采用中性电解质及阳离子交换膜
,宜采用中性电解质及阳离子交换膜
D.多孔电极可提高电极与电解质溶液的接触面积,提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.紫外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析
B.高聚物(![]() )属于可降解材料,工业上是由单体经过缩聚反应合成
)属于可降解材料,工业上是由单体经过缩聚反应合成
C.通过煤的液化可获得煤焦油、焦炭、粗氨水等物质
D.石油裂解的目的是为了提高轻质油的质量和产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO不仅是家用煤气的主要成分,也是重要的化工原料。工业上用简单有机物合成高分子涂料黏胶剂I的过程如下:
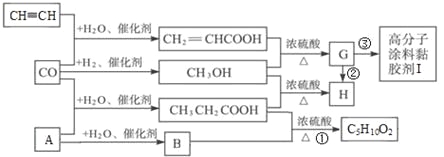
请回答下列问题:
(1)A的结构式_____。
(2)G分子中官能团名称是_____。
(3)写出反应①的化学方程式_____,指出②的反应类型_____。
(4)写出反应③的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温恒容密闭容器中充入1 mol X 和1 mol Y,发生反应 X(g)+2Y(g)![]() Z(g)+W(s),下列选项不能说明反应已达平衡状态的是
Z(g)+W(s),下列选项不能说明反应已达平衡状态的是
A.v正(X)=2v逆(Y)B.气体平均密度不再发生变化
C.容器内压强不再变化D.X的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,己知其燃烧热ΔH=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3 的说法中不正确的是
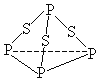
A. P4S3中磷元素为+3价
B. 分子中每个原子最外层均达到8电子稳定结构
C. 热化学方程式为P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H=-3677kJ/mol
D. 分子中存在极性键与非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. △H<0、![]() >0的反应在温度低时不能自发进行
>0的反应在温度低时不能自发进行
B. 煅烧石灰石能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的依据
D. 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A.该盐酸的物质的量浓度为4.0mol·L-1
B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2:1
C.生成的H2S气体在标准状况下的体积为8.96L
D.该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com