
【题目】某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
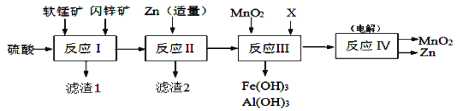
已知:反应Ⅰ中所有金属元素均以离子形式存在。有关常数:Ksp[Al(OH)3]=1.0×10-33、Ksp[Fe(OH)3]=3.0×10-39、Ksp[Mn(OH)2]=2.0×10-13、Ksp[Zn(OH)2]=1.0×10-17、Ksp(MnCO3)=2.0×10-11、Ka1(H2CO3)=4.0×10-7、Ka2(H2CO3)=5.6×10-11。回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式____________________________。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是___________。
(3)反应Ⅲ中MnO2的作用是_______________________,若反应后溶液中Mn2+、Zn2+均为0.1mol·L-1,需调节溶液pH范围为_______________(溶液中,当一种离子的浓度小于10-6mol/L时可认为已不存在),X可以是_________。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式________________________。本工艺可以循环利用的物质有MnO2、Zn和_________。
(5)MnCO3有多种用途。废水处理领域中常用NH4HCO3溶液将Mn2+转化为MnCO3,该反应的离子方程式为______。试通过题述有关数据简要计算说明该反应能进行的原因:____________________________。
【答案】CuS+MnO2+4H+![]() Cu2++Mn2++S↓+2H2OCu将Fe2+氧化为Fe3+5.0<pH<6.0(或5~6)bdMn2+2e+2H2O=MnO2+4H+H2SO4Mn2++2HCO3—= MnCO3↓+CO2↑+H2O由于K=7.0×106>105,所以该反应能进行
Cu2++Mn2++S↓+2H2OCu将Fe2+氧化为Fe3+5.0<pH<6.0(或5~6)bdMn2+2e+2H2O=MnO2+4H+H2SO4Mn2++2HCO3—= MnCO3↓+CO2↑+H2O由于K=7.0×106>105,所以该反应能进行
【解析】
(1) 软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)中加入硫酸,只有二氧化硅不能被硫酸溶解,因此滤渣1中含有SiO2,由于MnO2具有强氧化性,能够在酸性溶液中将CuS氧化生成硫,反应的离子方程式为CuS+MnO2+4H+![]() Cu2++Mn2++S↓+2H2O,故答案为:CuS+MnO2+4H+
Cu2++Mn2++S↓+2H2O,故答案为:CuS+MnO2+4H+![]() Cu2++Mn2++S↓+2H2O;
Cu2++Mn2++S↓+2H2O;
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,是因为锌能够将铜从溶液中置换出来,因此滤渣2的主要成分是Cu,故答案为:Cu;
(3) MnO2具有强氧化性,反应Ⅲ中MnO2能够将Fe2+氧化为Fe3+,若反应后溶液中Mn2+、Zn2+均为0.1mol·L-1,根据流程图,此过程中需要除去铁离子和铝离子,不能沉淀Mn2+、Zn2+。根据Ksp[Mn(OH)2]=2.0×10-13、Ksp[Zn(OH)2]=1.0×10-17,则需调节溶液中的c(OH-)分别小于![]() =
=![]() =
=![]() ×10-6 mol·L-1、
×10-6 mol·L-1、![]() =
=![]() =1.0×10-8 mol·L-1,则c(OH-)<1.0×10-8 mol·L-1,即pH<6,根据Ksp[Al(OH)3]=1.0×10-33、Ksp[Fe(OH)3]=3.0×10-39,则需调节溶液中的c(OH-)分别大于
=1.0×10-8 mol·L-1,则c(OH-)<1.0×10-8 mol·L-1,即pH<6,根据Ksp[Al(OH)3]=1.0×10-33、Ksp[Fe(OH)3]=3.0×10-39,则需调节溶液中的c(OH-)分别大于![]() =
=![]() =1.0×10-9 mol·L-1、
=1.0×10-9 mol·L-1、![]() =
=![]() =
=![]() ×10-11mol·L-1,则c(OH-)>1.0×10-9 mol·L-1,即pH>5,因此pH范围为5.0<pH<6.0,为了不引入杂质,X可以是Zn(OH)2和MnCO3,故答案为:将Fe2+氧化为Fe3+;5.0<pH<6.0(或5~6);bd;
×10-11mol·L-1,则c(OH-)>1.0×10-9 mol·L-1,即pH>5,因此pH范围为5.0<pH<6.0,为了不引入杂质,X可以是Zn(OH)2和MnCO3,故答案为:将Fe2+氧化为Fe3+;5.0<pH<6.0(或5~6);bd;
(4)反应Ⅳ中电极均是惰性电极,电解硫酸锰和硫酸锌的混合溶液,根据流程图,电解生了二氧化锰和锌,则阳极电极反应式为Mn2+2e+2H2O=MnO2+4H+。本工艺可以循环利用的物质有MnO2、Zn和硫酸,故答案为:Mn2+2e+2H2O=MnO2+4H+;H2SO4;
(5)废水处理领域中常用NH4HCO3溶液将Mn2+转化为MnCO3,反应的离子方程式为Mn2++2HCO3—= MnCO3↓+CO2↑+H2O,该反应的平衡常数K=![]() =
=![]() =
=![]() =7.0×106>105,所以该反应能进行,故答案为:Mn2++2HCO3—= MnCO3↓+CO2↑+H2O;由于K=7.0×106>105,所以该反应能进行。
=7.0×106>105,所以该反应能进行,故答案为:Mn2++2HCO3—= MnCO3↓+CO2↑+H2O;由于K=7.0×106>105,所以该反应能进行。


科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的容器中放入4mol N2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应进行到5min时,测得N2O5转化了20%,
4NO2(g)+O2(g)。反应进行到5min时,测得N2O5转化了20%,
(1)5min时,剩余N2O5的物质的量;
(2)前5min,v(NO2)为多少;
(3)5min时,N2O5的物质的量占混合气体总物质的量的百分比(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料。某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。回答下列有关问题。
(背景素材)Ⅰ.NO+CaO2=Ca(NO2)2;2NO2+CaO2=Ca(NO3)2;
II.亚硝酸具有一定的氧化性和还原性,酸性条件下:Ca(NO2)2能将I-氧化为I2;
Ⅲ.I2+2S2O32—=2I-+S4O62—
(制备Ca(NO2)2)该小组设计的制备装置如图所示(夹持装置略去)。
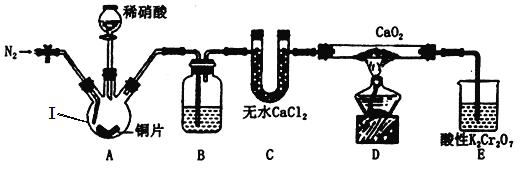
(1)仪器Ⅰ的名称是___________________;B中盛装的试剂是____________________。
(2)制备过程有关操作如下,正确顺序为_______、c、_______、_______、_______、_______。
a.向装置中通入N2 b.向仪器Ⅰ中滴加稀硝酸 c.点燃酒精灯 d.熄灭酒精灯 e.停止通入N2 f.关闭分液漏斗旋塞
(3)装置E中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3—,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式为__________________________。
(4)整个过程持续通N2的作用是______________、_____________、____________。
(测定Ca(NO2)2的纯度)该小组测定产品中Ca(NO2)2纯度的方法如下:a.称取mg产品、溶解、定容至250mL;b.移取25.00mL溶液于锥形瓶中,加入过量的V1 mLc1mol/L的KI溶液并酸化;c.以淀粉为指示剂,用c2mol/L的Na2S2O3溶液滴定。进行三次平行实验,消耗标准液体积平均值为V2 mL。
(5)测定过程所需仪器在使用前必须检查是否漏液的有______________________。
(6)该产品中Ca(NO2)2的质量分数为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)在恒温、恒容条件下,能说明可逆反应:H2(g)+I2(g) 2HI(g)达到平衡状态的是
A. 气体的压强保持不变 B. v(H2)正=2v(HI)逆
C. 气体的密度保持不变 D. 气体的颜色保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
① C2H2(g) +5/2O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
② C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
③ H2(g)+ ![]() O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) == C2H2(g)的△H为( )
A. +228.2 kJ·mol-1 B. -228.2 kJ·mol-1
C. +1301.0 kJ·mol-1 D. +621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国要求在全国范围内形成全民节能减排氛围。下列有关做法中不符合这一要求的是( )
A、将煤液化、气化,提高燃料的燃烧效率
B、在汽车上安装汽车尾气催化转化装置,使之发生反应:
2CO+2NO![]() 2CO2+N2
2CO2+N2
C、在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢氧燃料电池汽车
D、在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com