
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是:
A. 2.7 g 金属铝分别与足量的NaOH溶液和盐酸反应转移的电子数目均为0.3NA
B. 标准状况下,2.24 L Cl2与过量NaOH溶液反应,转移的电子总数为0.1 NA
C. 1L 1 molL-1 Na2CO3溶液中阴离子数小于NA
D. 2.3 g金属钠完全反应生成Na2O与Na2O2的混合物中阴离子数为0.05 NA
【答案】C
【解析】
A、2.7g铝的物质的量为0.1mol,而无论与盐酸还是氢氧化钠溶液反应后铝元素均变为+3价,故1mol铝均失去3mol电子,即0.3NA个,故A正确;B. 标准状况下,2.24LCl2的物质的量为![]() =0.1mol,由方程式Cl2+2NaOH=NaCl+NaClO+H2O可知,反应中氯元素化合价由0价升高为+1价,由0价降低为-1价,氯气起氧化剂与还原剂作用,各占一半,转移电子数目为0.1mol×
=0.1mol,由方程式Cl2+2NaOH=NaCl+NaClO+H2O可知,反应中氯元素化合价由0价升高为+1价,由0价降低为-1价,氯气起氧化剂与还原剂作用,各占一半,转移电子数目为0.1mol×![]() ×2×NAmol-1=0.1NA,故B正确;C、Na2CO3溶液中碳酸根离子水解生成碳酸氢根离子和氢氧根离子,阴离子总数增多,1L 1 molL-1 Na2CO3溶液中阴离子数大于NA,故C错误;D、2.3g钠的物质的量为0.1mol,而反应后生成的钠的化合物氧化钠或过氧化钠中,均是2个钠离子对应一个阴离子,故0.1mol钠离子对应0.05mol阴离子即0.05NA个,故D正确;故选C。
×2×NAmol-1=0.1NA,故B正确;C、Na2CO3溶液中碳酸根离子水解生成碳酸氢根离子和氢氧根离子,阴离子总数增多,1L 1 molL-1 Na2CO3溶液中阴离子数大于NA,故C错误;D、2.3g钠的物质的量为0.1mol,而反应后生成的钠的化合物氧化钠或过氧化钠中,均是2个钠离子对应一个阴离子,故0.1mol钠离子对应0.05mol阴离子即0.05NA个,故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用。它与二氧化碳反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如下实验装置:
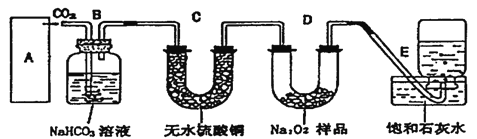
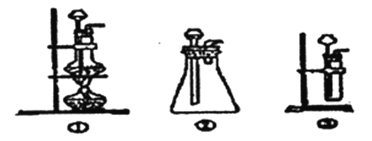
(l)A中制取CO2的装置,应从下列图①、②、③中选哪个图:_____。
B装置的作用是________, C装置内可能出现的现象是________。为了检验E中收集到的气体,在取出集气瓶后,用________的木条伸入集气瓶内,木条会出现________。
(2)若E中的石灰水出现轻微白色浑浊,请说明原因:________。
(3)若D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?________。
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值______(答大或小),相差约________mL(取整数值,所用数据均在标准状况下测定),这是由于________。
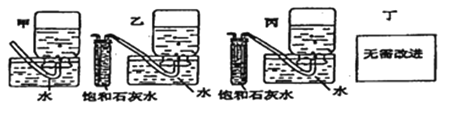
(5)你认为上述A~E的实验装置中,E部分是否安全、合理?E是否需要改为下列四项中的哪一项:________。(用甲、乙、丙、丁回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,原物质内仅有共价键被破坏,同时有离子键形成的是( )
A. 盐酸和NaOH溶液反应
B. 氯化氢溶于水
C. 稀硫酸与BaCl2溶液反应
D. 氯化氢与氨气反应生成NH4Cl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)22SO4的工艺流程:
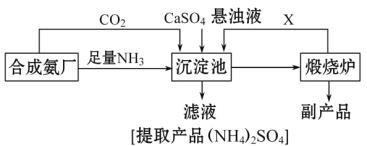
请回答以下问题:
(1)工业合成氨反应的条件是_____________________。沉淀池中发生的主要反应方程式是________________________。该反应能够发生的原因是__________________________。
(2)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是:__________(填序号)。
A.萃取 B.蒸发浓缩 C.冷却结晶 D.蒸馏
(3)上述生产流程中,有关NH3的作用及说明正确的是:__________(填序号)。
A.提供制备所需的氮元素
B.增大CO32-的浓度促进反应发生
C.作反应的催化剂
D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3
(4)该生产过程中的副产品是_______________,从绿色化学和资源综合利用的角度说明上述流程的主要优点是______________.缺点是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 16g CH4含有的原子数为NA
B. 17 g OH- 含有的质子数为9NA
C. 2g D2气体中含有的中子数为0.5 NA
D. 标准状况下22.4 L NH3含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍。电池总反应为:C2H5OH +3O2= 2CO2 +3H2O,电池示意图如下图。下面对这种电池的说法正确的是:
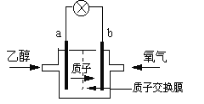
A. 标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
B. 电池工作时电子由b极沿导线经灯泡再到a极
C. 电池正极的电极反应为:4H+ +O2 +4e- =2H2O
D. b极为电池的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的短周期部分,表中字母分别表示一种元素。

请回答下列问题:
(1)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)____。
a.MnO2 b.NaCl c.Na2SO3 d.KMnO4
(2)d、e、h四种元素最高价氧化物对应的水化物的酸性由弱到强的顺序为(用化学式表示)________。b、c、f、g、h形成的简单离子的半径由小到大的顺序为_______(用离子符号填写)。
(3)在1L的密闭容器中,通入1molf2气体和3mola2气体,一定温度下反应生成fa3气体,2min时,测得f2的浓度为0.75mol·L-1,则2min时fa3的物质的量为_____mol;反应达到平衡状态时,若增大fa3的产率,可以采取措施(填序号)_____。
①升高温度 ②恒容充入氦气
③向密闭容器内充入f2气 ④及时分离出fa3气体
(4)d与a可形成化合物d5a12,试写出它的一氯取代物有一种的同分异构体的结构简式_____。
(5)a、d两种元素可形成多种化合物,其中化合物X的产量是衡量一个国家石油化工发展水平的标志。X可与H2O在一定条件下反应生成化合物乙醇,该反应的化学方程式为:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: ![]() +H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平.B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78.回答下列问题:
(1)A的电子式 ______________ ,A的结构简式 _______________ .
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式 ______________________,反应类型_______________。
(3)在碘水中加入B振荡静置后的现象_________________________
(4)B与浓H2SO4与浓HNO3在50-60℃反应的化学反应方程式 ________________________,反应类型______________________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量______(填“A>B”或“A<B”或“A=B”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com