
【题目】表为元素周期表的一部分,针对表中的①~⑨九种元素,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
4 | ⑧ | ⑨ |
(1)⑨的元素符号是 .
(2)在这些元素中,化学性质最不活泼的原子结构示意图为 .
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是(填化学式,下同),碱性最强的是 , 显两性的是 .
(4)将元素①与氢元素组成的最简单有机物和⑥的单质按1:1混合后的气体在光照条件下放置一段时间,最多能得到产物.
(5)用电子式表示④和⑥两元素形成化合物的过程为 .
【答案】
(1)Br
(2)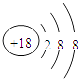
(3)HClO4;KOH;Al(OH)3
(4)HCl
(5)![]()
【解析】解:由元素在周期表的位置可知,①为C、②为F、③为Na、④为Mg、⑤为Al、⑥为Cl、⑦为Ar、⑧为K、⑨为Br,(1)⑨的元素符号是Br,所以答案是:Br;(2)稀有气体Ar化学性质稳定,核外电子数为18,各层电子数为2、8、8,原子结构示意图为: 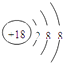 ,所以答案是:
,所以答案是: 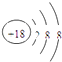 ;(3)根据元素周期律:周期表中从左到右失电子能力逐渐减弱,得电子能力逐渐增强,元素非金属性逐渐增强,从上到下失电子能力逐渐增强,得电子能力逐渐减弱,元素非金属性逐渐减弱,F没有含氧酸,上述元素F除外中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4 , K的金属性最强,则KOH的碱性最强,Al(OH)3为两性氢氧化物,所以答案是:HClO4;KOH;Al(OH)3;(4)甲烷与氯气按1:1混合,光照条件下,由于氯气不足,可发生多步取代反应,生成物有CH3Cl、CH2Cl2、CHCl3、CCl4、HCl,每步反应中生成的卤代甲烷与HCl都是1:1,故产物中HCl最多,所以答案是:HCl;(5)氯化镁属于离子化合物,用电子式表示其形成过程为:
;(3)根据元素周期律:周期表中从左到右失电子能力逐渐减弱,得电子能力逐渐增强,元素非金属性逐渐增强,从上到下失电子能力逐渐增强,得电子能力逐渐减弱,元素非金属性逐渐减弱,F没有含氧酸,上述元素F除外中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4 , K的金属性最强,则KOH的碱性最强,Al(OH)3为两性氢氧化物,所以答案是:HClO4;KOH;Al(OH)3;(4)甲烷与氯气按1:1混合,光照条件下,由于氯气不足,可发生多步取代反应,生成物有CH3Cl、CH2Cl2、CHCl3、CCl4、HCl,每步反应中生成的卤代甲烷与HCl都是1:1,故产物中HCl最多,所以答案是:HCl;(5)氯化镁属于离子化合物,用电子式表示其形成过程为: ![]() ,所以答案是:
,所以答案是: ![]() .
.


科目:高中化学 来源: 题型:
【题目】六种短周期元素在周期表中的相对位置如下所示,其中E元素原子核外电子总数是其最外层电子数的3倍。关于元素周期表及这六种元素性质,请回答:

(1)这六种元素的氢化物中,最稳定的是___________.(写化学式);
(2)AF2的结构式为_____________.
(3)在一定条件下,由B单质与H2反应生成1 molG气体时,放出的热量为46.2 kJ,写出该反应的热化学方程式:_____________________.
(4)工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式__________________________.该反应中被氧化的G与参与反应的G的质量之比__________.
(5)F的单质可由其氧化物与氢化物反应生成,写出该反应的化学方程式:__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C的简单离子和B的简单离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物中阴阳离子的个数比为1:1。根据判断出的元素及相应化学式回答问题:
(1)五种元素中,金属性最强的是_______(填元素名称),非金属性最强的元素是_____(填元素名称)。
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是________________________________________(用化学式表示)。
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为____________,其中存在的化学键类型为_________________________。
(4)E离子的结构示意图是_______________。单质E与水反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下经不同的化学反应,可以实现图示变化,A为酸式盐;B为无色无味气体;无色气体D可使红色石蕊试纸变蓝;X、F和Y为气体单质,且Y为有色气体,F为空气的主要成分之一;G为正盐,G和无色气体M在溶液中可反应生成B,反应⑤是常见工业原理. 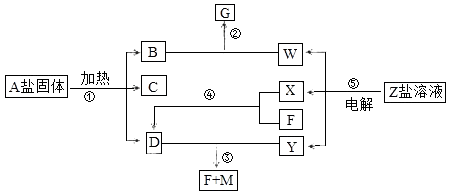
(1)写出下列物质的化学式:A;Y
(2)写出反应②的离子方程式 .
(3)写出反应③的化学方程式 .
(4)常温下pH=10,体积均为100mL的D、W两溶液与M反应,消耗的M的物质的量关系DW(填“大于”“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液体积比是( )
A.1:9
B.1:1
C.1:2
D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体.加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用.
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3 , 50%的硫酸物质的量浓度为(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为(填>、<、=“)40%“.
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3nH2O表示20%的发烟硫酸,则n=(保留两位小数).
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 .
(4)硫酸亚铁铵[(NH4)2SO4FeSO46H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL 2mol/L稀硝酸溶液处理,发生反应如下: 10NO3﹣+3Cu2S+16H+=6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+=3Cu2++3SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好与V mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3﹣+3Fe2++4H+=NO↑+3Fe3++2H2O
①V值范围 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液 (二甲胺在水中的电离与氨相似,在常温下Kb[(CH3)2NH·H2O]=1.6×10-4 )。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
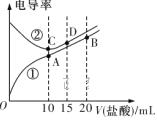
A. D点溶液中:2c(Na+)=3c(Cl-)
B. A点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C. 曲线②代表滴定二甲胺溶液的曲线
D. 在相同温度下,A、B、C、D四点的溶液中,水的电离程度最大的是C点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系且D为强电解质(其他相关物质可能省略)。下列说法不正确的是( )
![]()
A. 若A为非金属单质,则它与Mg反应的产物中阴、阳离子个数比可能为2∶3
B. 若A为非金属单质,则其组成元素在周期表中的位置可能处于第2周期ⅣA族
C. 不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下都能使铁和铝发生钝化
D. 若A是共价化合物,0.1molA分子中含有的电子数可能为NA(NA为阿伏加德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com