
����Ŀ��ͭ������֪������Ľ���֮һ��Ҳ�ǹ㷺ʹ�õĵ�һ�ֽ������ش��������⣺
��1������ͭ��ͭ���Ͻ𣩿���������������Ʒ���ڶ�������I2��Cu��______________��2��Ni�����>"�� ��<��������ԭ��Ϊ______________��
��2����[Cu��NH3��2]Cl��Һ��ͨ����Ȳ��C2H2�����壬�����ɺ���ɫ����Cu2C2��
��C2H2������![]() ����
����![]() ������Ŀ֮��Ϊ______________��̼ԭ�ӵ��ӻ���ʽΪ______________��
������Ŀ֮��Ϊ______________��̼ԭ�ӵ��ӻ���ʽΪ______________��
��д����Cu2C2��������C22-��Ϊ�ȵ������һ�ַ��Ӻ�һ������______________��
��3���Ҷ�����H2N-CH2CH2-NH2������Cu2+�γ����������Cu2+�Ķ����ⶨ��
���γɵ���������ṩ�¶Ե��ӵ�ԭ��Ϊ______________����Ԫ�ط��ţ���
���Ҷ���������Ԫ�صĵ縺���ɴ�С��˳��Ϊ______________���Ҷ�����ˮ���ܽ�Ƚϴ��ԭ��Ϊ______________��
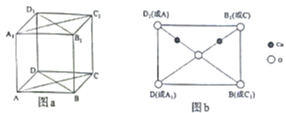
��4��ͭ�������ɵ�ij�ֻ����������������ͼa��ʾ��ͼb���ؾ����Խ���ȡ�õĽ�ͼ������������ԭ�Ӿ��ڶԽ����ϡ���ԭ�ӵ���λ��Ϊ______________����Cuԭ��֮����̾���Ϊdpm�������ӵ�������ֵΪNA���þ�����ܶ�Ϊ______________g��cm-3���г�����ʽ���ɣ���
���𰸡�> ![]() ʧȥ����ȫ������
ʧȥ����ȫ������ ![]() ���ӣ�
���ӣ�![]() ʧȥ����
ʧȥ���� ![]() ���� 3:2
���� 3:2 ![]()
![]() ����
���� ![]() ����
����![]()
![]()
![]() �Ҷ���������ˮ���Ӽ��γ���� 4
�Ҷ���������ˮ���Ӽ��γ���� 4 ![]()
��������
��1����Ϊ ![]() ʧȥ�ĵڶ������ӵ���ȫ������
ʧȥ�ĵڶ������ӵ���ȫ������ ![]() ���ӣ�����ʧȥ�ĵڶ���������
���ӣ�����ʧȥ�ĵڶ��������� ![]() ���ӣ�����ʧȥ��ǰ�����ף���I2��Cu��>I2��Ni����
���ӣ�����ʧȥ��ǰ�����ף���I2��Cu��>I2��Ni����
��2����![]() ��Ϊ
��Ϊ ![]() ����
����![]() ����һ��Ϊ
����һ��Ϊ ![]() ����ʣ������Ϊ
����ʣ������Ϊ ![]() ��������
�������� ![]() ��
�� ![]() ����
���� ![]() ������Ŀ֮��Ϊ 3:2����Ȳ�Ŀռ乹����ֱ���ͣ�����̼ԭ�ӵ��ӻ���ʽΪ
������Ŀ֮��Ϊ 3:2����Ȳ�Ŀռ乹����ֱ���ͣ�����̼ԭ�ӵ��ӻ���ʽΪ ![]() ��
��
��![]() �������
�����к��� ![]() ��ԭ�ӡ�10���۵��ӣ����������������
��ԭ�ӡ�10���۵��ӣ���������������� ![]() ��Ϊ�ȵ�����ķ���Ϊ
��Ϊ�ȵ�����ķ���Ϊ ![]() ����
���� ![]() ����������
����������![]() ��
��
��3��������Ϊ ![]() ���Ҷ��������Ҷ����е�
���Ҷ��������Ҷ����е� ![]() ԭ�Ӻ��й¶Ե��ӣ�Ϊ������е�
ԭ�Ӻ��й¶Ե��ӣ�Ϊ������е� ![]() �ṩ�¶Ե��ӡ�
�ṩ�¶Ե��ӡ�
���Ҷ��� ![]() �����к���
������� ![]() ��
��![]() ��
��![]() ����Ԫ�أ����ݵ縺�������ڱ��еı仯���ɣ�
����Ԫ�أ����ݵ縺�������ڱ��еı仯���ɣ�![]() ��
��![]() ��
��![]() �ĵ縺���ɴ�С��˳��Ϊ��
�ĵ縺���ɴ�С��˳��Ϊ��![]() ���Ҷ����к�N��H�����Ҷ���������ˮ���Ӽ��γ�����������Ҷ�����ˮ���ܽ�Ƚϴ�
���Ҷ����к�N��H�����Ҷ���������ˮ���Ӽ��γ�����������Ҷ�����ˮ���ܽ�Ƚϴ�
��4������֪������������ԭ�Ӿ��ڶԽ����ϣ���ͼb��ʾ����8��Oԭ���ھ����Ķ��㡢1��Oԭ���ھ��������ģ�4��![]() ԭ���ھ����ڣ����к��е�
ԭ���ھ����ڣ����к��е� ![]() ԭ�ӵĸ���Ϊ��
ԭ�ӵĸ���Ϊ��![]() �������к��е�
�������к��е� ![]() ԭ�ӵĸ���Ϊ4���þ���Ļ�ѧʽΪCu2O����ͼb��֪
ԭ�ӵĸ���Ϊ4���þ���Ļ�ѧʽΪCu2O����ͼb��֪ ![]() ԭ�ӵ���λ��Ϊ
ԭ�ӵ���λ��Ϊ ![]() ��
��
ÿ������������Ϊ��![]() ������֪
������֪ ![]() ԭ��֮����̾���Ϊ
ԭ��֮����̾���Ϊ ![]() �����ԶԽ���
�����ԶԽ��� ![]() Ϊ
Ϊ ![]() ������Ϊ�������������壬���Ծ��������Ϊ
������Ϊ�������������壬���Ծ��������Ϊ ![]() �����Ծ�����ܶ�
�����Ծ�����ܶ� ![]() ��
��


 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д� ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ����A:�ٷ��ڿ����п��������ɰ�ɫ����B���ڽ�A��ȼ������ʻ�ɫ�����ɵ���ɫ����C����A��B��C��������ɫҺ��D��Ӧ�����ɼ�������E������A��D��Ӧʱ���������ɿ�ȼ������F��C��D��Ӧ��������һ������G����F��G��Ϻ�����ɾ��ҷ�Ӧ��������ը��������D���ݴ��ж�:
��1��A______��B______��C______��D________��E____��F_______��G_______�����ѧʽ��
��2��д���йط�Ӧ�Ļ�ѧ����ʽ:
��___________________________________________��
��__________________________________________��
��__________________________________________��
��__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Դ������κ�����Ϊԭ���Ʊ�����K2FeO4�IJ����������£�
���Ʊ�NaClOǿ���Ա�����Һ��
�ٽ�20 mL NaOH��Һ��������b�У���ˮԡ��ȴ��ͨ��Cl2�����裬ֱ����Һ��Ϊ����ɫ����������ɫ��������Ϊֹ��װ������ͼ��ʾ����

�ڽ����ñ���NaClO�����ձ���������ˮԡ�У��ּ��μ���20 g NaOH���岢���Ͻ��裬���ˣ���NaClOǿ���Ա�����Һ��
(1)��װ����a�ܵ�������_____________________________________________��
(2)д����װ���з�Ӧ�Ļ�ѧ����ʽ_____________________________________��
(3)ʯ�����������___________________________________________________��
(4)��Ӧ����������ˮԡ��ȴ��ԭ����___________________________________��
�ϳ�K2FeO4��
�ٳ�ȡ5.05 g Fe(NO3)3��9H2O����Է�������Ϊ404�����壬����ˮԡ�з����������������Һ�������Ͻ��裬��Ӧ1Сʱ����Һ�����Ϻ�ɫ����Na2FeO4����
�����ķ����ȥNa2FeO4ˮ��õ���Fe(OH)3���壬���ϲ���Һ�����Ϻ�ɫ����
����ڵ��ϲ���Һ�л�������KOH������Һ50.00mL����ˮԡ����5 min�����ˣ���K2FeO4����Է�������Ϊ198���ֲ�Ʒ��
�ܽ��ֲ�Ʒ�ؽᾧ�����������ϴ�ӣ����º�ɣ��ô���Ʒ2.13 g��
(5)�ϳ�Na2FeO4�����ӷ���ʽΪ____________________________________��
(6)���̢ۼ��뱥��KOH��Һ���ɵõ�K2FeO4�ֲ�Ʒ��ԭ����__________��
(7)�������ϴ�ӵ�Ŀ����__________________________________________��
(8)K2FeO4�IJ���Ϊ___________��������0.1%����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(ICl3)��ҩ��ϳ�����;�dz��㷺�����۵㣺33�棬�е㣺73�棬��ˮ��Ӧ��ʵ���ҿ�����ͼװ��(���ּг�װ������ȥ)��ȡICl3���Ʊ��ķ�Ӧԭ����![]() ������˵����ȷ����
������˵����ȷ����
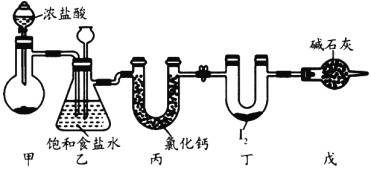
A.����װ�ü��Ʊ�����ѡ�õ�ҩƷΪ�������̺�Ũ����
B.װ�����г���©��Һ������˵����װ�ÿ��ܷ�������
C.װ�ñ����Ȼ��Ƶ������Ǹ���Cl2
D.װ�ö�������ICl3����Ԫ�صĻ��ϼ�Ϊ-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͼ�ӡˢ��·����ͭԪ�غ����ϸߣ�Ϊ���������Դ�����Ϊ��ʵ��С��̽�����÷Ͼ�ӡˢ��·�����Ʊ�����������������ͼ��ʾ��
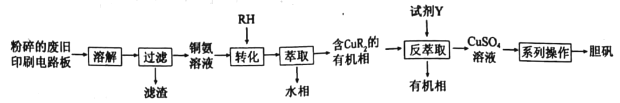
��ش�
��1�����ܽ⡱�����У�Ϊѡ����ʵ��ܽ��Լ����������Ϻ�С��ͬѧ�������ʵ�顣
ʵ���� | ͭƬ����/g | �Լ������� | ���� |
1�� | 0.5 | 30%H2O250mL������ˮ8mL | 10h����Һ��Ϊdz��ɫ��ͭƬ���渽����ɫ���� |
2�� | 0.5 | 30%H2O250mL��5mol��L-1H2SO48mL | ��ʼͭƬ�������������ɣ�������죬40min����Һ��ɫ����ͭƬ������� |
3�� | 0.5 | 30%H2O250mL��5mol��L-1��ˮ8mL | ������������������ҺΪ����ɫ��ͭƬ���渽��������ɫ���� |
ע������ɫ��ҺΪͭ����Һ��
��1��ʵ���з�����Ӧ�Ļ�ѧ����ʽΪ______________��
��ʵ���Ҽ���2��ʵ���в�������IJ���������Ϊ______________��
����2��ʵ����ȣ�3��ʵ����ŵ���������ͭ�������ӿ��˷�Ӧ���ʣ��䲻��֮��Ϊ______________��
��Ϊ�ֲ�3��ʵ��IJ��㣬��С��������иĽ��������4��ʵ�飨���±������õ���Ԥ�ڵ�ʵ������
ʵ���� | ͭƬ����/g | �Լ������� | ���� |
4�� | 0.5 | 30%H2O250mL5mol��L-1��ˮ8mL�������Լ�X | ���������������ݣ���ҺΪ����ɫ��ͭƬ�����Թ��� |
��4��ʵ���У��Լ�xӦΪ______________��
��2����ת����ʱͭ����Һ�е�Cu��NH3��42+���л���RH������Ӧ�����ӷ���ʽΪ______________��������ȡ�������У������Լ�Y�Ļ�ѧʽΪ______________��
��3����ϵ�в���������ָ_____________����ѡ����ĸ����
A.����Ũ�������ȹ��ˡ�ϴ�ӡ�����
B.����Ũ������Һ������־�Ĥ��ֹͣ���ȣ���ȴ�����ˡ�ϴ�ӡ�����
C.����Ũ������������������ֹͣ���ȣ���ȴ�����ˡ�ϴ�ӡ�����
��4��Ϊ�ⶨͭ����Һ��ͭԪ�صĺ������ɲ������·�����
i.��ȡ500mLͭ����Һ����ƿ�У��μ�ϡH2SO4��������Һ��pHΪ3-4
��.�����ʵ�������KI��Һ��������3mL0.5%������Һ��![]() ����
����
��.��0.1000mol��L-1Na2S2O3����Һ�ζ����յ㣬���ı�Һ���Ϊ5.80mL��I2+2S2O32-=2I-+S4O262-����
��iii�еζ����յ�ʱ����Һ����ɫ�仯Ϊ______________��
�ڸ�ͭ����Һ��ͭԪ�صĺ���Ϊ______________g��mL-1��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��60%��þ���Ժ�ˮ���Ӻ�ˮ����ȡþ����������ͼ��ʾ������˵����ȷ����( )
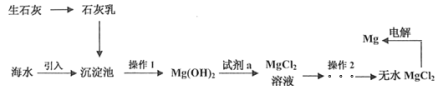
A.�ù��������漰�ķ�Ӧ�зֽⷴӦ�����Ϸ�Ӧ���û���Ӧ
B.����1Ϊ���ˣ�ʵ������Ϊ�ӿ�����ٶ�Ӧ�ò���������Һ��
C.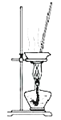 ����2ʵ���ҿ��ø�װ�ö�MgCl2��Һ��������Ũ��������ȴ�ᾧ�����ˮMgCl2
����2ʵ���ҿ��ø�װ�ö�MgCl2��Һ��������Ũ��������ȴ�ᾧ�����ˮMgCl2
D.�ù��յ��ŵ���ԭ����Դ�㷺��ͬʱ�����Ҫ�Ļ���ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ȷ��ij�����Ƿ���ʣ���ѡ�Լ�(����������)�ﲻ��ʵ��Ҫ�����( )
A.K2SO3�Ƿ�����(BaCl2��Һ)B.������ˮ�Ѿ���ȫ����(��ɫʯ����Һ)
C.KI�Ƿ�����(������Һ)D.FeSO4�Ƿ�����(KSCN��Һ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������0.1molL��1������Һ��pH=a��������ʹ��ҺpH=��a+1���Ĵ�ʩ��
A. ����Һϡ�͵�ԭ�����2��B. ���������Ĵ����ƹ���
C. ��������0.2 molL��1����D. ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά��pH���ȶ�������������������ѧ��Դ�ĸ�Ч�����Ⱦ�����Ҫ���塣
(1)�����£��ڲ�ͬ�Լ��м����������ϵpH�ı仯���±���ʾ��
�Լ� | pH | ||
��ʼ | ͨ��0.01 mol HCl���� | ����0.01 mol NaOH���� | |
i.1 L H2O | 7 | a | 12 |
ii.0.10 mol CH3COOH+0.10 mol CH3COONa���Ƴ�1 L����Һ | 4.76 | 4.67 | 4.85 |
��a=____________(����ͨ��HCl����ǰ����ϵ������仯)��
�ڽ�ϻ�ѧ��������Լ�ii�����Ե�ԭ��____________��
���Լ�ii����Ũ�ȹ�ϵ��ȷ����____________(�����)��
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
���ɱ������ݿ�֪���Լ�ii��pH��һ��������ͼ��Ӱ�첻����Һ�������ܶԿ���������ǿ�ᡢǿ����ʵ�ϡ�ͣ���������Һ��pH������������ó�Ϊ�������á�������Һ���л������õ���____________(�����)��
a. HCl��NaCl b. Na2CO3��NaHCO3 c. NH3��H2O-NH4Cl d. KOH��KCl
(2)������ҺӦ����ij��Һ����������ȶ���ص�����������õ��װ��ʾ��ͼ����ͼ��ʾ����ص��ܷ�Ӧ���£�
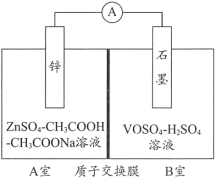
Zn+2VOSO4+2H2SO4![]() ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O
��֪��VOSO4��V2(SO4)3�ĵ��뷽��ʽ�ֱ�ΪVOSO4=VO2++SO42-��V2(SO4)3=2V3++3SO42-��
�ٷŵ�ʱ��B����c(H+)____________(��������������С������������)����ϻ�ѧ����˵�����ɣ�______��
�ڳ��ʱ��A���е�c(H+)�仯������ԭ����____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com