
【题目】湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体可能是( )
①Cl2②NO2③H2S④SO2⑤溴蒸气⑥HCl中的
A.①④⑤
B.①②⑤
C.①②⑥
D.①②④⑤
科目:高中化学 来源: 题型:
【题目】为了探究不溶性盐X(仅含5种元素)的组成和性质,设计并完成如下实验(所加试剂均过量,气体体积均在标准状况下测定)。

请回答:
(1)X的组成元素为H、O和______(用元素符号表示),气体C的电子式为_______。
(2)写出反应①的离子方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4gCO和CO2的混合气体,在标准状况下其体积为 8.96L。请回答下列问题:
(1)该混合气体的平均摩尔质量 为 _____。
(2)该混合气体 中碳原子的个数 为 _____;(用N A表示阿伏加德罗常数的值)
(3)将该混合气体依次通过如下图所示装置,最后收集在气球中(体积在标准状况下测定) .

气球中收集到的气体的摩尔质量 _____;
② 气球中收集到的气体的电子总数为 _____;(用 NA表 示阿伏加德罗常数的值 )
③ 标况下气球中收集到的气体的体 积为 _____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化学平衡正向发生移动时,平衡常数K值一定增大
B. HS-的电离方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. 由水电离出的c(H+)=1×10-13mol/L的溶液中,可能大量共存的离子:Fe3+、K+、NH4+、 SO42-、Cl-、ClO-
D. AlCl3溶液与Na2CO3溶液混合发生反应:2Al3++3CO32-=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马日夫盐(Mn(H2PO4)2)是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如下:
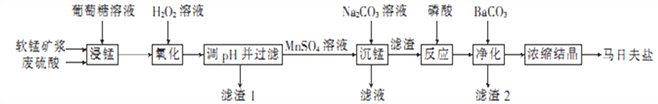
(1)粉碎软锰矿制成矿浆的目的是_________________________________________,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为__________。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为_______________________________。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表所示、“调pH并过滤”时,应调整的pH范围为____________,滤渣1的主要成分为_________(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为_____________________________________。
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐__________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,铁片、铜片和CuSO4溶液可以构成原电池或电解池,下列说法正确的是( )

A. 构成原电池时,Cu极反应式为Cu-2e-=Cu2+
B. 构成电解池时,Cu极质量可能减少也可能增加
C. 构成电解池时,Fe极质量一定减少
D. 构成的原电池或电解池在工作时的反应原理一定不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mLFeSO4溶液 | 10 mLNH3 | 生成白色沉淀,后变色 |
2 | 20 mLH2S | 12mLSO2 | |
3 | 30 mLNO2 | 10 mLH2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mLCl2 | 40 mLNH3 |
试回答下列问题:
(1)实验1中,沉淀最终变为_____色,写出沉淀变色的化学方程式_________________________。
(2)实验2甲针筒内的现象是:有_____________生成,活塞______移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式_______。
(4)实验4中,已知:Cl2 + NH3 → N2+ HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为____________,最后针筒中剩余气体的体积约为_________mL。
【答案】红褐色4Fe(OH)2+O2+2H2O=4Fe(OH)3淡黄色固体向内NaOHNO3NO2+H2O = 2HNO3+NO黄绿色变为无色5
【解析】
+2价的铁离子易被氧气氧化成+3价的铁离子,NH3与FeSO4溶液的水反应生成Fe(OH)2沉淀,Fe(OH)2沉淀易被空气中的氧气氧化;H2S和SO2反应生成单质硫和水,过量的SO2用碱吸收;NO2与水反应生成硝酸和一氧化氮;氯气的颜色为黄绿色,氨气与氯气发生氧化还原反应生成氮气和氯化氢,3Cl2+2NH3═N2+6HCl,过量的氨气与产物氯化氢反应生成氯化铵。
(1)氨气溶于水得到氨水,反应的化学方程式为:NH3+H2ONH3H2O,氨水与硫酸亚铁溶液反应生成氢氧化亚铁白色沉淀,反应的化学方程式为:FeSO4+2NH3H2O═Fe(OH)2↓+(NH4)2SO4,Fe(OH)2白色沉淀,在空气中易被空气中的氧气氧化,迅速变成灰绿色,最终变为红褐色,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3。(2)15mLH2S和10mLSO2反应2H2S+SO2=3S+2H2O,反应产生固体硫和液态水,SO2过量,针筒内压强减小,活塞自动向内移动,析出浅黄色固体,过量的SO2用NaOH溶液吸收。(3)二氧化氮气体溶于水,与水反应生成硝酸和一氧化氮,反应的化学方程式为:3NO2+H2O=2HNO3+NO,由方程式可知可知30 mLNO2生成10mL无色的NO气体。(4)氯气的颜色为黄绿色,氨气与氯气发生氧化还原反应生成氮气和氯化氢,气体颜色变浅,反应的化学方程式为:3Cl2span>+2NH3═N2+6HCl,由方程式可知,15 mLCl2消耗10ml氨气、生成30ml氯化氢,过量的氨气与氯化氢恰好反应生成氯化铵,反应中有大量的白烟产生。
【点睛】
该题主要考查了元素及其化合物的知识,涉及氮、氯、硫的化合物的性质,注意根据化合物的性质认识理解化学反应,正确分析实验现象。
【题型】填空题
【结束】
30
【题目】有一瓶硫酸和硝酸的混合溶液(1)取出10.00mL该溶液,加入足量BaCl2溶液,过滤、洗涤、干燥得4.66g沉淀。滤液跟40 mL 2.00mol/L的NaOH溶液恰好反应使溶液呈中性,则混合液中硫酸和硝酸的物质的量浓度分别为多少____?(2)取出20.00mL该溶液,加入足量Cu粉,若氧化产物只有NO,可产生NO的物质的量是多少____ ?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素和化合物是生物体的生命活动共同的物质基础,图示中a、b是有机小分子,c代表化学元素,甲、乙、丙是生物大分子。请据图回答下列问题:

(1)甲、c分别是_________、__________。
(2)b在核糖体上通过______________方式结合成丙,b的结构通式可表示为___________。
(3)若丙由n个b形成,则丙(链状物质)中至少含有________个肽键,至少含有______个氮原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com