
【题目】马日夫盐(Mn(H2PO4)2)是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如下:
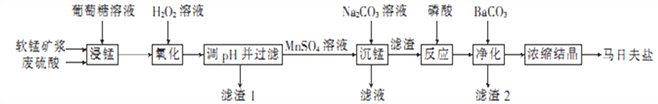
(1)粉碎软锰矿制成矿浆的目的是_________________________________________,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为__________。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为_______________________________。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表所示、“调pH并过滤”时,应调整的pH范围为____________,滤渣1的主要成分为_________(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为_____________________________________。
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐__________t。
【答案】 增大反应物接触面积,加快反应速率,提高原料利用率 12:1 2Fe2++H2O2+2H+![]() 2Fe3++2H2O 5.0~7.8 Fe(OH)3和Al(OH)3 MnCO3+2H3PO4
2Fe3++2H2O 5.0~7.8 Fe(OH)3和Al(OH)3 MnCO3+2H3PO4![]() Mn(H2PO4)2 +CO2↑+H2O 2.59(或2.5935)
Mn(H2PO4)2 +CO2↑+H2O 2.59(或2.5935)
【解析】(1)粉碎软锰矿制成矿浆的目的是增大反应物接触面积,加快反应速率,提高原料利用率; 由葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O可知:葡萄糖做还原剂,MnO2做氧化剂;根据电子守恒:设MnO2为xmol, (C6H12O6)ymol,2x=y×(4-0)×6;x/y=12:1,正确答案:增大反应物接触面积,加快反应速率,提高原料利用率;12:1。
(2)反应中的亚铁离子在酸性条件下被双氧水氧化为铁离子,离子方程式为2Fe2++H2O2+2H+![]() 2Fe3++2H2O;正确答案:2Fe2++H2O2+2H+
2Fe3++2H2O;正确答案:2Fe2++H2O2+2H+![]() 2Fe3++2H2O。
2Fe3++2H2O。
(3)“调pH并过滤”时,主要除去铁离子和铝离子,变为沉淀而除去,根据表中数据可知应调整的pH范围为5.0--7.8,得到的沉淀(滤渣1)为Fe(OH)3和Al(OH)3 ;正确答案:5.0--7.8 ;Fe(OH)3和Al(OH)3。
(4)沉锰过程中形成碳酸锰沉淀,再加入磷酸,碳酸锰变为马日夫盐,反应的化学方程式为MnCO3+2H3PO4![]() Mn(H2PO4)2 +CO2↑+H2O ;正确答案:MnCO3+2H3PO4
Mn(H2PO4)2 +CO2↑+H2O ;正确答案:MnCO3+2H3PO4![]() Mn(H2PO4)2 +CO2↑+H2O。
Mn(H2PO4)2 +CO2↑+H2O。
(5)根据锰元素的量守恒规律:1t该软锰矿含有锰元素的量为:1×106×87%×(1-9%)÷87=0.0091×106mol, 马日夫盐Mn(H2PO4)2的量为0.0091×106mol,质量为0.0.0091×106×249=2.26×106g=2.26t;正确答案:2.26。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】结合图示实验装置,回答下列问题。
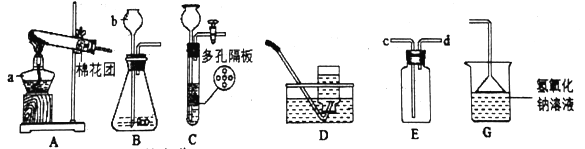
(1)图中b仪器的名称:______________。
(2)用高锰酸钾制取氧气,选用的发生装置是__________。实验室制取二氧化碳时,如需要E装置干燥二氧化碳,则E装置中应盛放__________,与B装置相比,若用C装置作为制取二氧化碳的发生装置,其优点为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(乙酰水杨酸,![]() )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:

制备基本操作流程如下:
![]()
主要试剂和产品的物理常数如下表所示:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 易水解 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是________________________________。
(2)合成阿司匹林时,最合适的加热方法是______________________。

(3)提纯粗产品流程如下,加热回流装置如图:
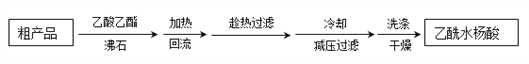
①沸石的作用是__________________________________;
②冷凝水的流出方向是________________(填“b”或“c”);
③使用温度计的目的是_____________________________________________________。
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(![]() ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐渐滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图。下列分析不正确的是

A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7,此时酸碱恰好中和
C. b、c两点水的电离程度:b<c
D. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体可能是( )
①Cl2②NO2③H2S④SO2⑤溴蒸气⑥HCl中的
A.①④⑤
B.①②⑤
C.①②⑥
D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系正确的是( )
A. 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B. pH=8.3的NaHS溶液:c(Na+)>c(HS-)>c(S2-)>c(H2S)
C. pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D. 0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)海水淡化的方法主要有:__________、______________、_____________。
(2)金属冶炼的实质是金属化合物中的金属离子得电子被________(填“氧化”或“还原”)为金属单质的过程,写出冶炼金属钠的化学方程式:_________________________。
(3)实验室里,常用加热铵盐和碱的混合物的方法制氨,写出实验室制氨的化学方程式:________;氨溶于水得氨水,氨水呈___________性(填“酸”或“碱”); 密度比水_______;(填“大”或“小”)写出向AlCl3溶液中滴加过量氨水的离子方程式:_________________________。
(4)溴主要以Br-形式存在于海水中,工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物。
Br2可用热空气吹出,其原因是:_________;步骤③所发生的化学反应方程式为:_______________。
【答案】蒸馏法电渗析法离子交换法还原 2NaCl(熔融)![]() 2Na+Cl2↑2NH4Cl+Ca(OH)2
2Na+Cl2↑2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O碱小Al3++3NH3·H2O = Al(OH)3↓+3NH4+溴的沸点较低,易挥发5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
CaCl2+2NH3↑+2H2O碱小Al3++3NH3·H2O = Al(OH)3↓+3NH4+溴的沸点较低,易挥发5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
【解析】
海水淡化的常用方法有海水冻结法、电渗析法、蒸馏法、离子交换法;金属冶炼的实质其实就是把金属从化合态变为游离态,用还原的方法使金属化合物中的金属阳离子得电子变成金属原子,原理就是利用氧化还原反应原理在一定条件下用还原剂把金属矿石中的金属离子还原成金属单质;实验室用消石灰与氯化铵共热的方法制备氨气,氨气溶于水溶液呈碱性,密度比水小;溴易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质。
(1)淡化海水,应将水与海水中的盐进行分离,常用方法有蒸馏、电渗析以及离子交换法等。(2)金属冶炼的实质其实就是把金属从化合态变为游离态,用还原的方法使金属化合物中的金属阳离子得电子变成金属原子,工业上用电解熔融的氯化钠冶炼金属钠,反应的化学方程式为:2NaCl(熔融)![]() 2Na+Cl2↑。(3)实验室用消石灰与氯化铵共热的方法制备氨气,消石灰与氯化铵共热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2
2Na+Cl2↑。(3)实验室用消石灰与氯化铵共热的方法制备氨气,消石灰与氯化铵共热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;氨气溶于水溶液呈碱性,氨水密度比水小;氨水与氯化铝溶液反应生成氢氧化铝沉淀和氯化铵溶液,反应的离子方程式为:Al3++3NH3·H2O = Al(OH)3↓+3NH4+。(4)海水提溴时,溴的沸点较低,易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质,反应的化学方程式为5NaBr+NaBrO3+3H2SO4=3Na2SO4
CaCl2+2NH3↑+2H2O;氨气溶于水溶液呈碱性,氨水密度比水小;氨水与氯化铝溶液反应生成氢氧化铝沉淀和氯化铵溶液,反应的离子方程式为:Al3++3NH3·H2O = Al(OH)3↓+3NH4+。(4)海水提溴时,溴的沸点较低,易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质,反应的化学方程式为5NaBr+NaBrO3+3H2SO4=3Na2SO4
+3Br2+3H2O。
【题型】填空题
【结束】
27
【题目】一瓶未知溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH 溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
根据上述实验事实,可知原溶液中肯定含有的离子是_________;肯定没有的离子是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲是人体细胞化合物含量的扇形图,图乙为人体内组成染色体的两种重要化合物A与C的化学组成关系,据图分析回答:

(1)若图甲表示细胞鲜重,则①化合物是_______,若图甲表示细胞干重,则①化合物是________,它在图乙中的物质是_______(用字母表示)。
(2)图乙中b分子通过______方式形成B,连接两个b分子的化学键叫做_______,若用结构式表示应为__________。
(3)在图乙中,a和b两种化合物其它的组成元素分别是_______、_______,化合物单体a的名称是________________。
(4)我们知道人的红细胞和心肌细胞的主要成分都是蛋白质,但这两种细胞的功能却完全不同,请你从蛋白质的结构方面做出解释_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com