
【题目】为探究外界条件对可逆反应A(g)+B(g)![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1molB,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为II、III、IV。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1molB,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为II、III、IV。
A | B | C | |
I | 0.050mol·L-1 | 0.050mol·L-1 | 0.050mol·L-1 |
II | 0.070mol·L-1 | 0.070mol·L-1 | 0.098mol·L-1 |
III | 0.060mol·L-1 | 0.060mol·L-1 | 0.040mol·L-1 |
IV | 0.080mol·L-1 | 0.080mol·L-1 | 0.12mol·L-1 |
针对上述系列实验,下列结论中错误的是
A. 由I中数据可计算出该温度下反应的平衡常数K=20
B. II可能是通过增大C的浓度实现的
C. 若III只是升高温度,则与I比较,可以判断出正反应一定是放热反应
D. 第IV组实验数据的得出,通过压缩容器的体积就可以实现
【答案】D
【解析】把平衡时各物质的浓度代入平衡常数表达式进行计算得:K=![]() mol-1·L,故A正确;计算平衡常数:K II =
mol-1·L,故A正确;计算平衡常数:K II =![]() ,说明Ⅰ与Ⅱ是相同温度下的平衡状态,增大C物质的浓度,平衡左移,A、B的浓度也会增大,但是平衡时C的浓度一定比开始时的大,故B正确;升高温度,C的浓度减小,而A、B浓度增大,说明平衡向逆反应方向移动,根据平衡移动原理,升高温度使平衡向吸热反应方向移动,所以逆反应为吸热反应,则正反应为放热反应,故C正确;D、计算平衡常数:KⅣ=
,说明Ⅰ与Ⅱ是相同温度下的平衡状态,增大C物质的浓度,平衡左移,A、B的浓度也会增大,但是平衡时C的浓度一定比开始时的大,故B正确;升高温度,C的浓度减小,而A、B浓度增大,说明平衡向逆反应方向移动,根据平衡移动原理,升高温度使平衡向吸热反应方向移动,所以逆反应为吸热反应,则正反应为放热反应,故C正确;D、计算平衡常数:KⅣ=![]() = 18.75mol-1·L≠KⅠ,说明Ⅳ和Ⅰ是不同温度下的平衡状态,只通过压缩容器的体积不能实现由平衡状态Ⅰ到平衡状态的Ⅳ转化,故D错误。
= 18.75mol-1·L≠KⅠ,说明Ⅳ和Ⅰ是不同温度下的平衡状态,只通过压缩容器的体积不能实现由平衡状态Ⅰ到平衡状态的Ⅳ转化,故D错误。


科目:高中化学 来源: 题型:
【题目】盐酸、硝酸、硫酸在工业生产中具有重要的作用。
(1)“王水”是浓盐酸和浓峭酸按体积比3: l组成的混合物,“王水”溶金的原理为HNO3+3HCl=Cl2+NOCl+2H2O,金离子与氯离子形成AuCl4-离子,增强了金属的还原能力。
① 试写出金与王水反应生成H[AuCl4]的化学方程式:_________;其中AuCl4-的配位数是________;
② 已知:NOCl的熔点-645℃,沸点-5.5℃,NOCl固体的晶体类型是__________;
③ 组成NOCl分子的三种元素中,电负性N_____O(填“>”、“<”或“=”);熔沸点H2O____NH3(填“>”、“<”或“=”);与NH3互为等电子体的阳离子有________(写出一种即可)。
(2)硝酸在有机反应中也有重要用途。TNT炸药、苦味酸是硝酸与甲苯、苯酚发生取代反应制成的。其中甲苯分子中碳原子的杂化方式为______, 1mol甲苯分子中含有σ键的数目为_____;试解释在水中苯酚溶解度大于甲苯的原因________。

(3)在硝酸工业中有一种重要金属即为Cu,CuCl晶胞结构如图所示。已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶胞边长为_______pm (只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )

A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B. 晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中与每个K+距离最近的K+有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—F是几种典型有机代表物的分子模型,请看图回答下列问题。
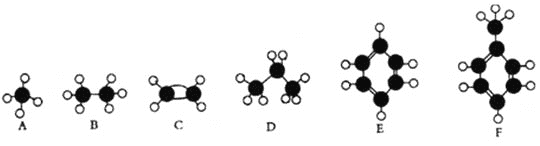
(1)常温下含碳量最高的气态烃是________(填对应字母);
(2)能够发生加成反应的烃有 ___________(填数字)种;
(3)一卤代物种类最多的是 ___________(填对应字母);
(4)写出实验室制取C的化学方程式 _____________________________________________________;
(5)写出E发生溴代反应的化学方程式__________________________________________________;
(6)按系统命名法填写下列有机物的名称: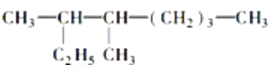 的名称是:___________________________________________________________________。
的名称是:___________________________________________________________________。
2,6-二甲基-4-乙基-2-辛烯的结构简式是: _____________________________________________,
1mol该烃完全燃烧需消耗氧气 _______________ mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组内的两种物质发生反应时,其产物不随反应物用量比的改变而发生变化的是
A. C和O2 B. NaOH溶液和CO2
C. Na2CO3溶液和盐酸 D. Na和Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A的各级电离能数据如下:
I1 | I2 | I3 | I4 | I5 | I6 | |
I/(kJ·mol-1) | 568 | 1517 | 9745 | 10978 | 13931 | 17978 |
则元素A常见价态是( )
A.+1B.+2C.+3D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、
CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
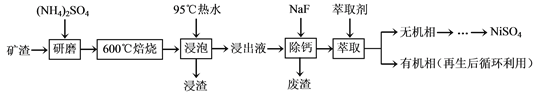
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是___________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为___________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com