
| A、S |
| B、Cl2 |
| C、NaOH |
| D、CH4 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA | ||
B、标准状况下,a L的氧气和氮气的混合物含有的分子数为(
| ||
| C、60 g SiO2晶体中含有2NA个Si-O键 | ||
| D、标准状况下,11.2 L乙醇完全燃烧产生的CO2的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、Cl-、SO42? |
| B、Cu2+、K+、SO42-、NO3- |
| C、K+、NH4+、SO42-、CO32? |
| D、Ba2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
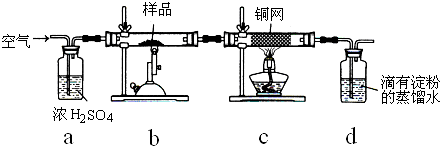
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
(1)如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 强电解质 | AlCl3 | HClO4 | H3PO4 | HClO |
| 弱电解质 | CH3COOH | HF | BaSO4 | Ca(OH)2 |
| 非电解质 | 酒精溶液 | NH3 | H2O | SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
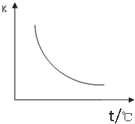 工业上制备H2的一种重要方法是:CO( g)+H2 O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数 K 与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质 的浓度(mol?L-1)随时间的变化关系如表:
工业上制备H2的一种重要方法是:CO( g)+H2 O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数 K 与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质 的浓度(mol?L-1)随时间的变化关系如表:| 时间/min | CO(g) | H2O | CO2 | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.238 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C1 | C1 |
| 4 | C1 | C2 | C1 | C1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com