
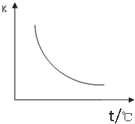
 工业上制备H2的一种重要方法是:CO( g)+H2 O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数 K 与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质 的浓度(mol?L-1)随时间的变化关系如表:
工业上制备H2的一种重要方法是:CO( g)+H2 O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数 K 与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质 的浓度(mol?L-1)随时间的变化关系如表:| 时间/min | CO(g) | H2O | CO2 | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.238 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C1 | C1 |
| 4 | C1 | C2 | C1 | C1 |
| CO的浓度变化 |
| CO的起始浓度 |
| [CO2]?[H2] |
| [CO]?[H2O] |
| a×a |
| (0.200-a)?(0.300-a) |
| CO的浓度变化 |
| CO的起始浓度 |
| 0.12 |
| 0.200 |


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
| A、不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
| B、电离平衡常数(K)越小,表示弱电解质电离能力越弱 |
| C、多元弱酸各步电离平衡常数相互关系为:K1<K2<K3 |
| D、CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
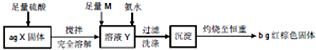
| A、取少量溶液Y,加入KSCN溶液,如果溶液不变红,则X中不含Fe3O4 | ||
| B、向钾氨水后得溶液中滴加FeCl2,如果生成红褐色沉淀,说明氨水已过量 | ||
| C、m可以是H2O2或NaClO,在实验过程中,理论上消耗两者物质的量之比为1;2 | ||
D、当b<
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取氢氧化钠20.0 g |
| B、定容时俯视观察刻度线 |
| C、移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗 |
| D、移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14.2g |
| B、19.6g |
| C、28.4g |
| D、30.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、18.4mol/LH2SO4
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、18.4mol/LH2SO4| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中 ②分别投入大小、形状相同的铜、铁、镁 | 反应速率镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com