
| A、不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
| B、电离平衡常数(K)越小,表示弱电解质电离能力越弱 |
| C、多元弱酸各步电离平衡常数相互关系为:K1<K2<K3 |
| D、CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 |


科目:高中化学 来源: 题型:
| A、7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA | ||
B、标准状况下,a L的氧气和氮气的混合物含有的分子数为(
| ||
| C、60 g SiO2晶体中含有2NA个Si-O键 | ||
| D、标准状况下,11.2 L乙醇完全燃烧产生的CO2的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
(1)如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 强电解质 | AlCl3 | HClO4 | H3PO4 | HClO |
| 弱电解质 | CH3COOH | HF | BaSO4 | Ca(OH)2 |
| 非电解质 | 酒精溶液 | NH3 | H2O | SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在豆浆里加入盐卤做豆腐 |
| B、在河流入海处易形成沙洲 |
| C、“尿毒症”患者做血液透析治疗 |
| D、三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过滤的方法分离Fe(OH)3胶体和HCl溶液 |
| B、用托盘天平称取25.12gNaCl固体 |
| C、分别含有Mg2+、Cu2+和Na+的三种盐溶液,用NaOH溶液就能一次鉴别开 |
| D、从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤:溶解→过滤→蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x=10时,溶液中有NH4+、Al3+、SO42-,且c( NH4+)>c(Al3+) |
| B、x=15时,溶液中有NH4+、SO42-,且c(NH4+)<2c(SO42-) |
| C、x=20时,溶液中有NH4+、Al3+、OH-,且c(OH-)<c(Al3+) |
| D、x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)=c(Ba2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
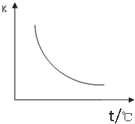 工业上制备H2的一种重要方法是:CO( g)+H2 O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数 K 与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质 的浓度(mol?L-1)随时间的变化关系如表:
工业上制备H2的一种重要方法是:CO( g)+H2 O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数 K 与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质 的浓度(mol?L-1)随时间的变化关系如表:| 时间/min | CO(g) | H2O | CO2 | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.238 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C1 | C1 |
| 4 | C1 | C2 | C1 | C1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com