
| A、盐酸多 | B、醋酸多 |
| C、二者相同 | D、无法比较 |
科目:高中化学 来源: 题型:
| A、不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
| B、电离平衡常数(K)越小,表示弱电解质电离能力越弱 |
| C、多元弱酸各步电离平衡常数相互关系为:K1<K2<K3 |
| D、CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、18.4mol/LH2SO4
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、18.4mol/LH2SO4| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中 ②分别投入大小、形状相同的铜、铁、镁 | 反应速率镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 0.3 mol?L-1 CH3COOH和3 L 0.1 mol?L-1 CH3COOH中的H+数目 |
| B、1 L 0.3 mol?L-1 CH3COOH和3 L 0.1 mol?L-1 CH3COOH的电离常数 |
| C、在4NH3+6NO═5N2+6H2O反应中,被氧化和被还原的N原子数 |
| D、纯水在25℃和80℃时的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
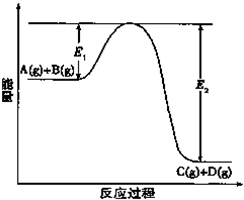 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
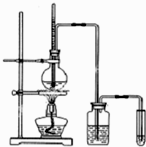 下面是实验室制乙烯并检验其性质的装置图,请回答:
下面是实验室制乙烯并检验其性质的装置图,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氧酸具有氧化性,无氧酸则不具有氧化性 |
| B、阳离子只有氧化性,阴离子只有还原性 |
| C、失电子难的原子获得电子的能力一定强 |
| D、由X变为X2+的反应是氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com